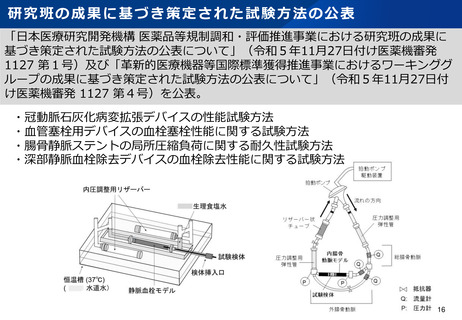
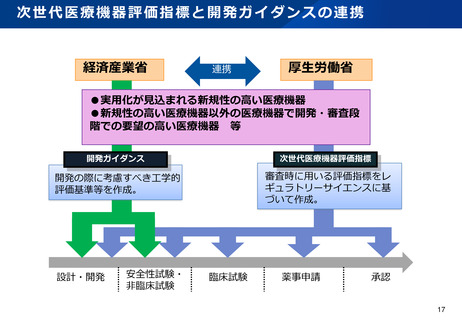
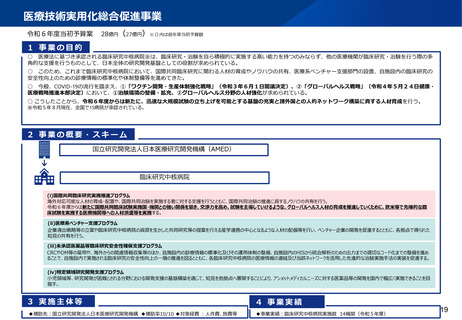
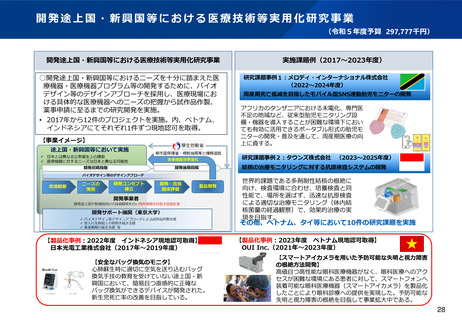
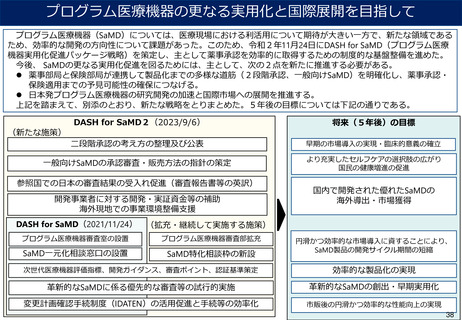
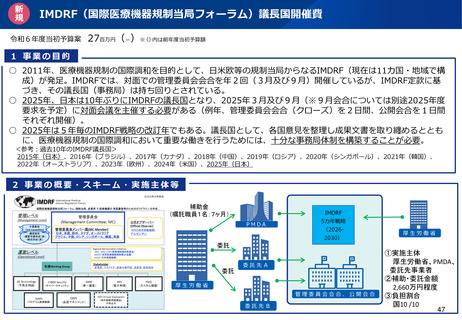
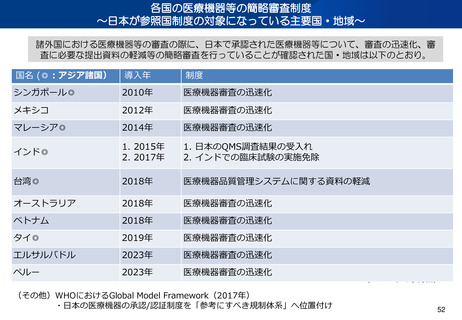
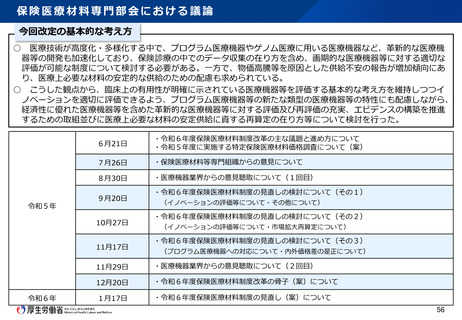
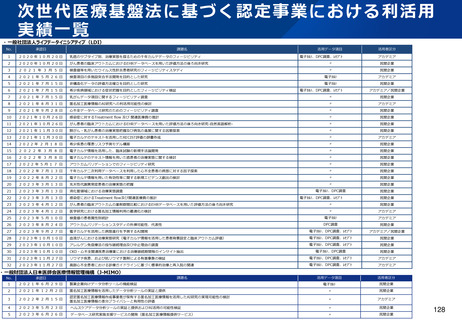
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
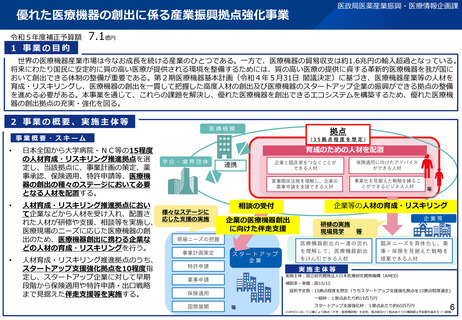
1 事業の目的
○ 小児用医療機器は、医療上の必要性は高いものの、患者数が少ないなどの臨床的側面と採算性の問題により、臨床
試験の実施による製品開発が困難であり、特に埋植型の医療材料等の場合、体格等の違いから成人用で承認取得した
製品では代用ができず、小児患者にとって必要な医療が提供できない状況にある。
○ 近年、医療機器の薬事申請において、臨床試験データの代替となる根拠としてリアルワールドエビデンスや臨床評
価報告書の活用を推進しているものの、国内小児レジストリで収集される臨床データが限定的であり、リアルワール
ドエビデンスの活用には限界がある。
○ そのため、既存の成人用医療機器の臨床データを小児用医療機器に外挿する評価手法を構築し、ガイドライン化す
ることにより、臨床試験を行わずに小児用医療機器の早期実用化につなげる。
2 事業の概要・スキーム
・
小児用製品の開発ニーズが高い製品(令和4年度
実施)を対象として、
・ 小児用として評価すべきポイント及び評価の考え
方を科学的に検討するとともに、
・ 成人用医療機器の承認時データを基に、小児用と
しての有効性及び安全性等の科学的評価が可能な外
挿性評価ツールとしてin silicoの評価手法を開発す
る。
3 実施主体等
実施主体:国立医薬品食品衛生研究所
小児用
in silico評価により
最適なサイズを決定
臨床データなし
で承認
成人用
臨床データに
基づいて評価・承認
ステントグラフト
人工股関節
4 事業実績
ー
15