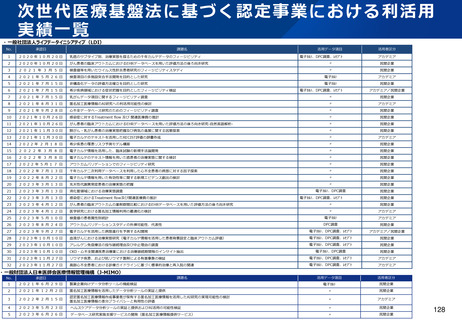
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
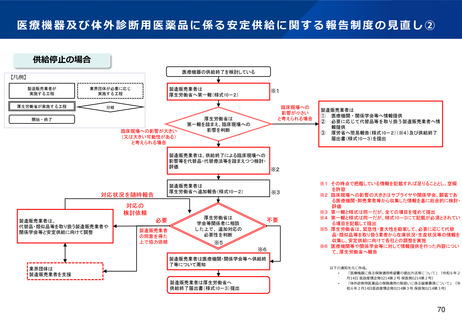
実施項目②
3.早期実用化のための体制強化等
実施項目
(1)
PMDAの審査・相談体制、市販後体制の強化
① PMDAの「プログラム医療機器審査室」を「プログラム医療機器審査部」に組織改編し、
プログラム医療機器に係る相談・審査体制を強化する。
② プログラム医療機器の不具合報告や添付文書の改訂等、市販後安全対策に不慣れな企業へ
の伴走型支援を行う。
(2)
PMDAのSaMDに特化した相談区分の新設
① PMDAにプログラム医療機器に特化した相談区分を新設する。
② PMDAに1回の相談申込で一定期間であれば複数回の相談を実施できる「サブスクリプ
ション型相談」を新設する。
(3)
産学官連携フォーラム・サブフォーラム開催
SaMD産学連携フォーラム・サブフォーラムを毎年度開催する。
(4)
承認事例公開DBの充実化
プログラム医療機器の承認事例公開DBを充実させる。
https://www.pmda.go.jp/review-services/drug-reviews/review-information/devices/0018.html
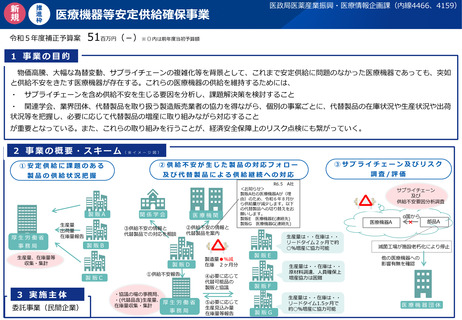
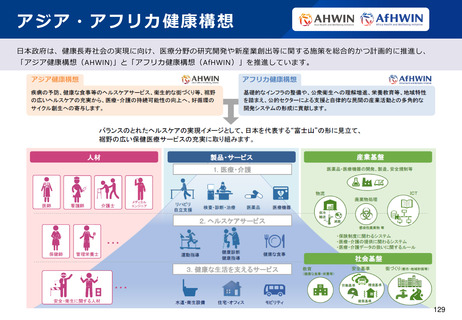
4.日本発SaMD国際展開支援
実施項目
(1)
海外のSaMDに関する薬事承認・販売制度等の
調査
海外のSaMD薬事制度及び市販されているSaMDの販売制度に係る実態調査を実施し、海外と
日本のSaMD薬事制度及び販売制度の違いを明確にする。
(2)
参照国での日本のSaMDの審査結果の受入れ促
進
海外審査当局が日本のSaMDの承認・認証結果等を広く参照できるよう、PMDAでプログラム
医療機器の審査報告書、認証基準等の英語版を策定・公表する。
(3)
厚生労働省の体制強化
厚生労働省におけるプログラム医療機器の参照国調整等を行う体制整備を図る。
(4)
PMDAアジア事務所の整備
① PMDAが公開しているSaMDに関する審査関連資料に基づくワークショップを開催する。
② SaMDの審査に活用できる標準・指標等に関する情報共有及びワークショップを開催する。
③ SaMDの各国規制制度の構築における知識・経験を共有・支援する。
(5)
現地での事業環境整備支援(キーパーソンとの
関係構築等)
海外のキーパーソン(医師等)との関係構築等の事業環境整備を支援する。
41