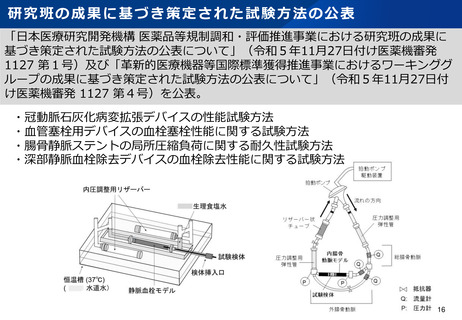
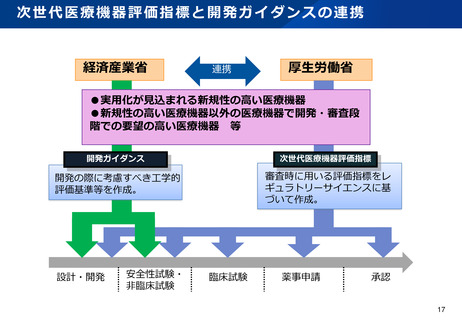
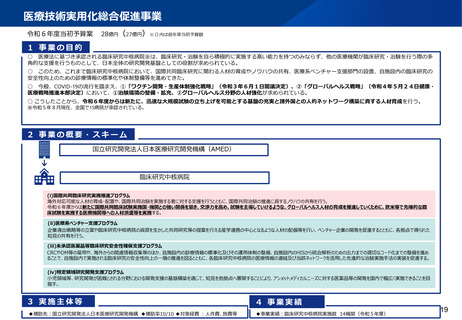
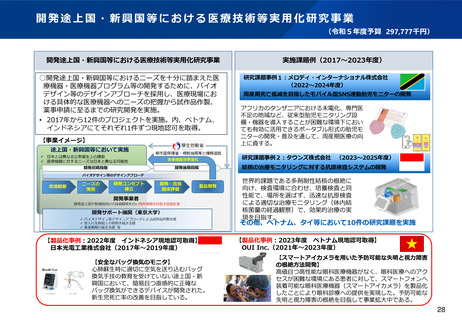
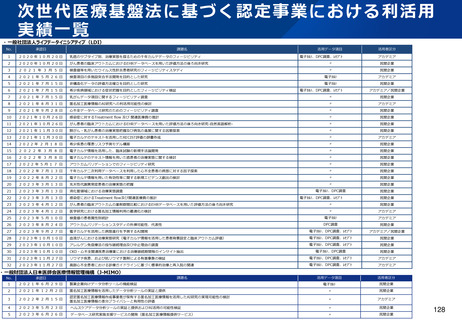
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
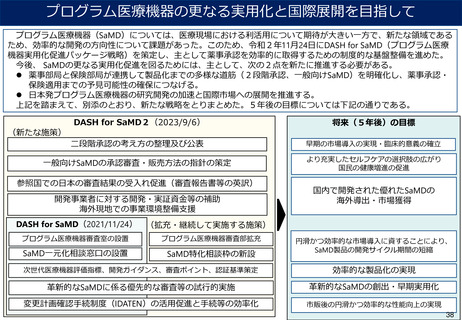
Ⅰ アジア医薬品・医療機器規制調和グランドデザイン ・同実行戦略
○「アジア健康構想」を具体化し、関係省庁が一体となって規制調和及びその関連事項に取り組む
・アジア諸国における、経済発展や疾病構造の変化に伴う、優れた医薬品・医療機器等に対するニーズの高まり。
・アジア諸国の国際規制調和に支援・協力し、垣根のないマーケットの整備により、医薬品・医療機器等への迅速なアクセスを可能にする。
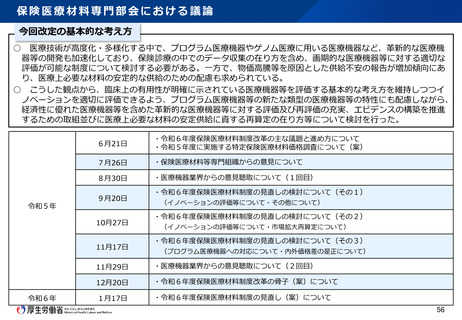
Ⅱ アジア医薬品・医療機器トレーニングセンター(平成28年4月:PMDAに設置)
○アジア規制当局担当者を対象に、現地に赴いた研修を含め、アジア規制当局の要
望のある分野や審査・査察等の能力に応じ効果的なトレーニング機会を提供
アジア医薬品・医療機器トレーニングセンター
日本
① アジアの規制当局担当者を招聘
したトレーニングセミナー
※令和4年度までに世界85ヵ国/地域及びWHOからのべ2,570人の規制当局担当者が参加
○医療機器の審査、安全対策等に関するセミナーを開催。
→ 日本の医薬品・医療機器等に関する規制等について、アジア規制当局の理
解促進。アジア各国・域内の規制水準の向上に貢献。
アジア現地
③APECの国際共同治験
現地に赴いて、講義・
ケーススタディ・実施研修 の中核トレーニング施設
として整備
②
Ⅲ 主要な国際会議
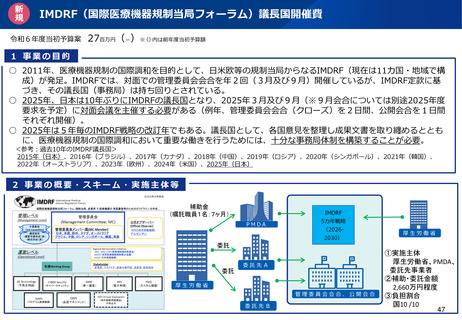
○IMDRF (国際医療機器規制当局フォーラム):
日米欧などの規制当局で医療機器の承認審査等のためのガイドラインを作成。
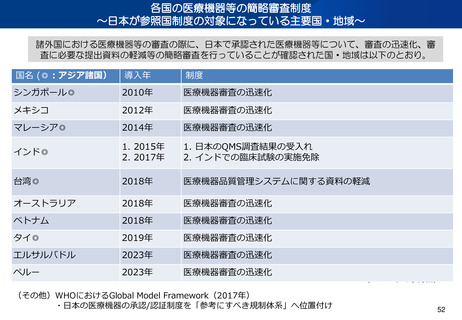
○二国間シンポジウム等:
韓国・台湾・タイ・インドネシア・インド・ブラジル等の規制当局と協働し、官民協働の公開シンポジウム・官官バイ
会合を通じて、規制調和・規制協力を促進(年1回程度の開催、場所は日本・相手国で交互又はオンラインで実施)
53