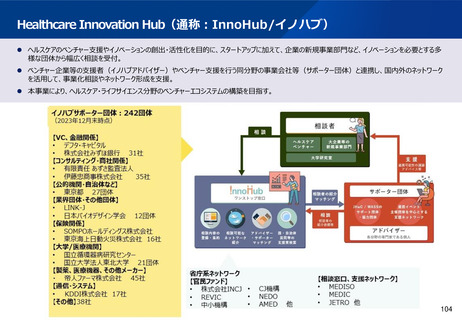
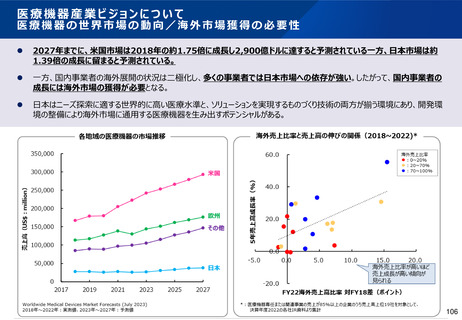
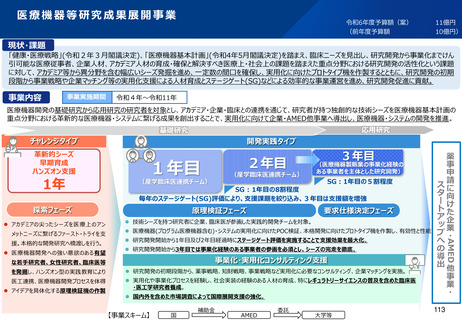
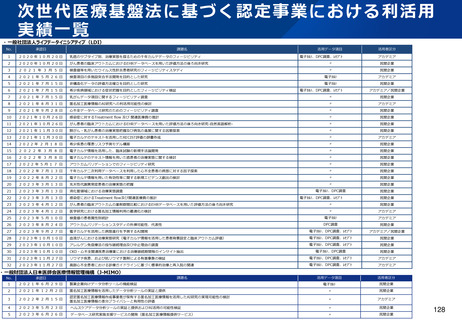
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
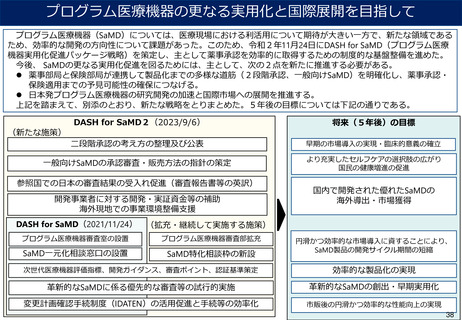
使用実績を踏まえた評価が必要な製品に対する対応
➢ 有用性の評価に長期間の使用実績が必要な医療機器等におけるイノベーションの評価をさらに充実
させる観点から、チャレンジ権の取得に係る申請については、保険適用後1年間は申請可能にする
とともに、製造販売業者が関与のうえで保険適用後にデータを収集する場合にチャレンジ申請の対
象となることを明確化する。
➢ 体外診断用医薬品においても、保険適用後に既収載品と比較した有用性が示される場合があると考
えられることを踏まえ、技術料に包括して評価されている体外診断用医薬品についても、チャレン
ジ申請の対象とする。
(保険適用後に既収載品と比較した有用性が示された体外診断用医薬品の例)
2009年 新製品:
高感度トロポニン
製造販売承認
発症後6時間
での診断に有用
臨床的意義に関するエビデンスが集積し、患者の診療フ
ローが変化するとともに、患者アウトカムと関連性も確立
2013年:
ST上昇型急性心筋梗塞の診療に関す
るガイドライン
• 「超急性期(発症後2時間以内)の
診断に有用であることが示されている」
2014年:
経皮的冠動脈形成術・冠動脈ステン
ト留置術の算定要件
• 心筋トロポニンが高値であることが要
件として追加(詳細は参考資料)
発症後2時間
での診断に有用
2018年:
急性冠症候群ガイドライン
• 「搬入時の数値が高値で
あるほど死亡リスクが高い」
※ 業界意見陳述資料より抜粋
57