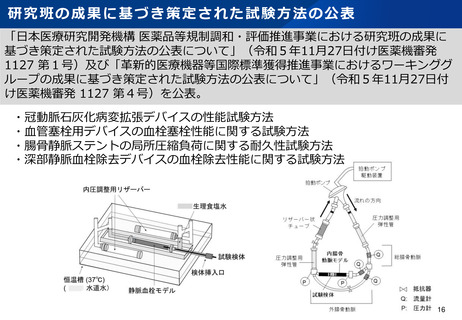
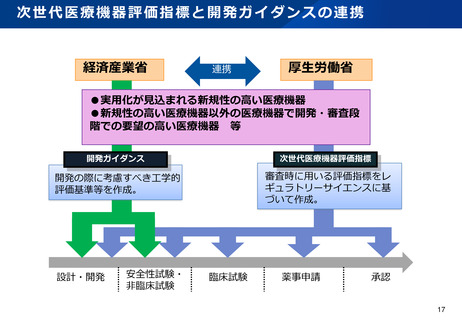
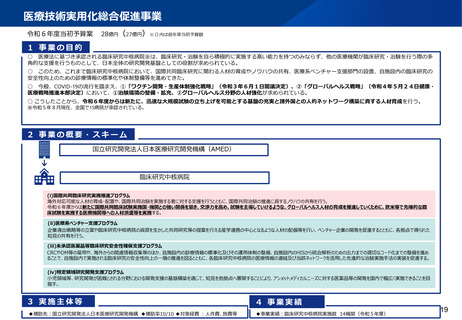
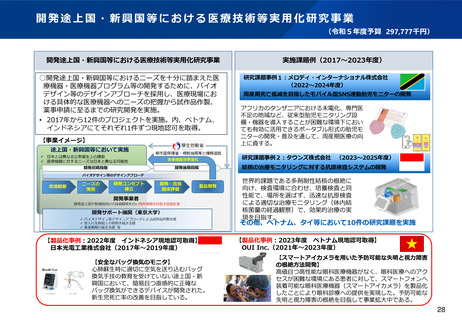
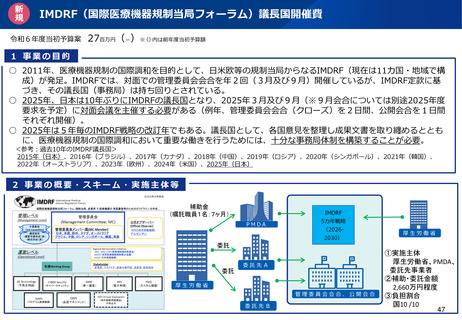
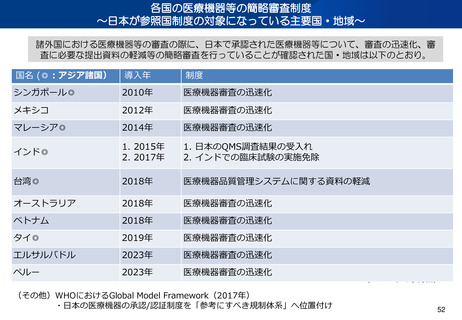
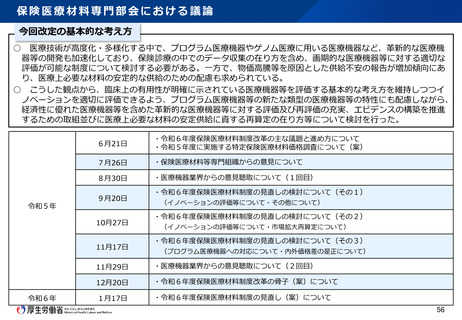
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
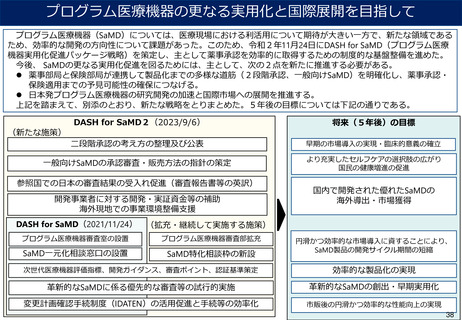
(DASH for SaMD 2)
1.萌芽的シーズの早期把握と審査の考え方の公表
3.早期実用化のための体制強化等
(1)萌芽的シーズに対する製品ライフサイクルを踏まえた相談
の実施
• SaMD開発に必要な情報のYouTube等を通じた動画発信
• PMDAとその他の相談事業(MEDISO、MEDIC、InnoHub
等)との積極的な連携
• スタートアップと既存企業の連携支援
(2)医療機器開発等に資するガイドライン等の策定・公表
• SaMDに係る次世代医療機器評価指標、開発ガイダンス、
審査のポイント及び認証基準等の策定・公表
(3)家庭(一般)向けSaMDの承認審査の考え方(医療現場向
けSaMDからの転用を含む)の整理・公表
(1)PMDAの審査・相談体制、市販後体制の強化
• 「プログラム医療機器審査部」に組織改編し、大幅に体制強化
• 市販後安全対策に不慣れな企業への伴走型対応
(2)PMDAのSaMDに特化した相談区分の新設
• プログラム医療機器に関する特化した相談区分の新設
• 1回の相談申込で一定期間であれば複数回の相談を実施できる
「サブスクリプション型」相談の導入
(3)産学官連携フォーラム・サブフォーラム開催
(4)承認事例公開DBの充実化
2.SaMDの特性を踏まえた実用化促進
4.日本発SaMD国際展開支援
(1)二段階承認の考え方の整理及び公表・承認事例の公表
・ リアルワールドデータの活用等(データの信頼性の検討)
(2)変更計画確認手続制度(IDATEN)の活用促進と手続等の
効率化
(3)革新的なSaMDに係る優先的な審査等の試行的実施
• 優先相談、事前評価の充実、優先審査等による早期実用化
(4)医療現場向け・家庭(一般)向けSaMDの販売方法に関す
る明確化のための指針等の策定
(5)改良医療機器に関する審査報告書の作成・公表
(6)開発事業者に対する開発・実証資金等の補助(海外展開に
関する開発・実証を含む)
(1)海外のSaMDに関する薬事承認・販売制度等の調査
https://www.pmda.go.jp/review-services/drug-reviews/reviewinformation/devices/0018.html
(2)参照国での日本のSaMDの審査結果の受入れ促進
• PMDAが公開しているSaMDに関する審査報告書、認証基準策
定の考え方、認証基準等の英訳・公表
(3)厚生労働省の体制強化
• 参照国調整等のための体制整備
(4)PMDAアジア事務所の整備
• 審査関連資料、標準・指標等に関するワークショップ開催
(5)現地での事業環境整備支援(キーパーソンとの関係構築等)
39