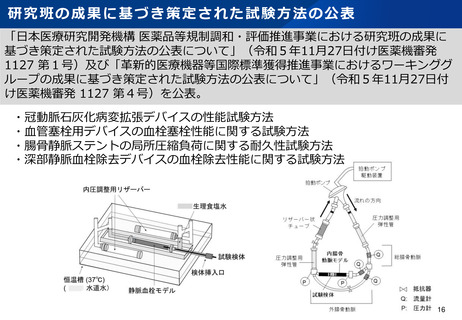
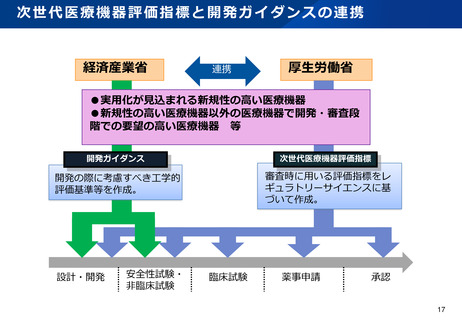
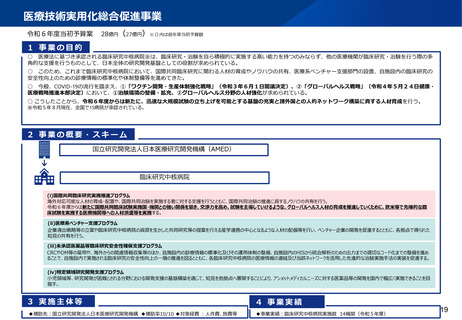
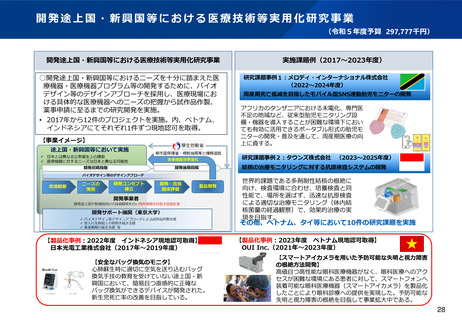
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
⚫ 1996年、GHTFの加盟国以外の国の規制当局及び当該国の医療機器業界が中心にな
り設立(当初名称はAHWP(Asian Harmonization Working Party))
⚫ 2021年、対象国がアジア地域から世界に拡大し、名称がGHWPに変更
⚫ GHTF(IMDRF)で合意された医療機器規制に関する文書を普及し、国際規制調和を図
ることを目的
⚫ 日本(厚生労働省及びPMDA、産業界)は、医療機器規制の国際調和
活動に積極的に貢献する観点から、2022年にGHWPへの加盟申請を
行い、2023年2月の年次総会で加盟が承認
⚫ 現在の参加国は33か国。議長(2023年~2025年)は中国NMPA
連携
Capacity Building
Secretariat Team
Technical Committee (TC)
Advisory Panel to TC
GHWP Administration
Services Limited (ASL)
Working Groups (WGs)
WG1 – 市販前(一般MD)
WG4 – 市販後
WG5 – 性能と安全性に関する臨床エビデンス
WG7 – QMS(運用実施)
http://www.ahwp.info
WG2 – 市販前(IVDD)
WG8 – 規格基準
WG3 – 市販前(Software)
会合参加:Opt in/Opt out
成果受容:自発判断
意思決定:コンセンサス方式
WG6 – QMS(監査・評価)
WG9 – UDIと命名法
49