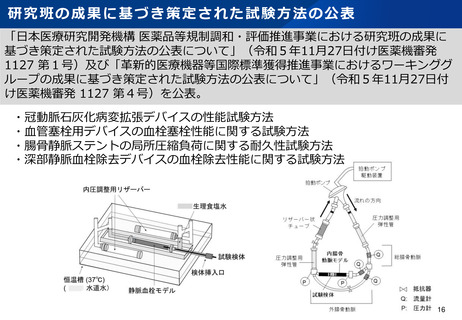
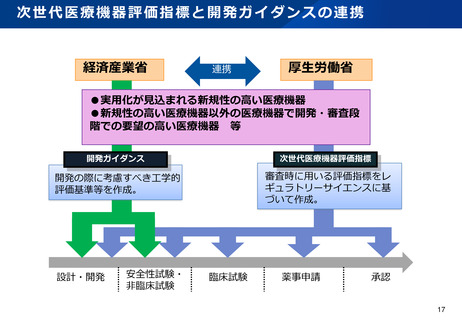
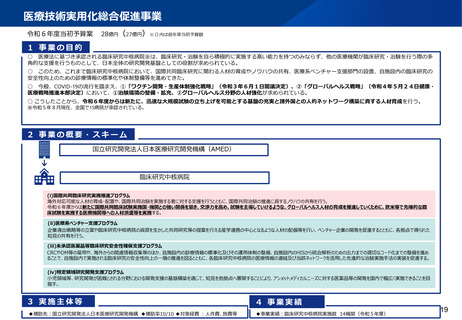
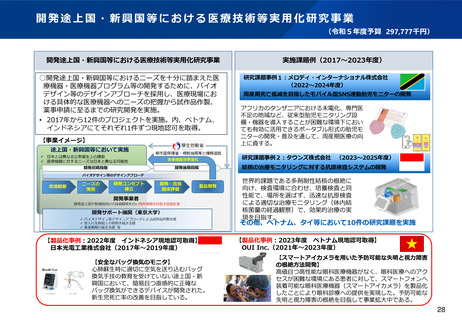
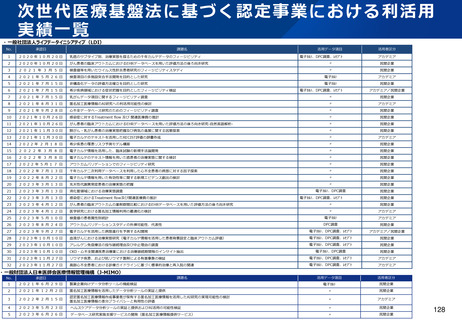
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (52 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
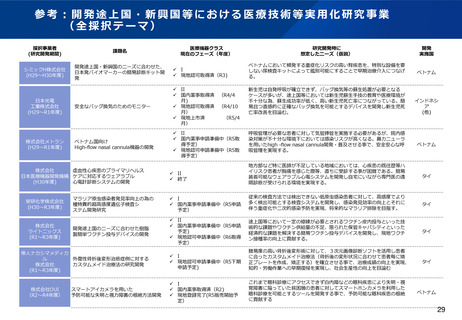
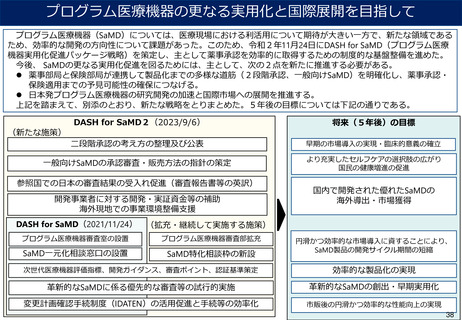
~日本が参照国制度の対象になっている主要国・地域~
諸外国における医療機器等の審査の際に、日本で承認された医療機器等について、審査の迅速化、審
査に必要な提出資料の軽減等の簡略審査を行っていることが確認された国・地域は以下のとおり。
国名 (◎:アジア諸国)
導入年
制度
シンガポール◎
2010年
医療機器審査の迅速化
メキシコ
2012年
医療機器審査の迅速化
マレーシア◎
2014年
医療機器審査の迅速化
インド◎
1. 2015年
2. 2017年
1. 日本のQMS調査結果の受入れ
2. インドでの臨床試験の実施免除
台湾◎
2018年
医療機器品質管理システムに関する資料の軽減
オーストラリア
2018年
医療機器審査の迅速化
ベトナム
2018年
医療機器審査の迅速化
タイ◎
2019年
医療機器審査の迅速化
エルサルバドル
2023年
医療機器審査の迅速化
ペルー
2023年
医療機器審査の迅速化
(その他)WHOにおけるGlobal Model Framework(2017年)
・日本の医療機器の承認/認証制度を「参考にすべき規制体系」へ位置付け
(2024年1月現在)
52