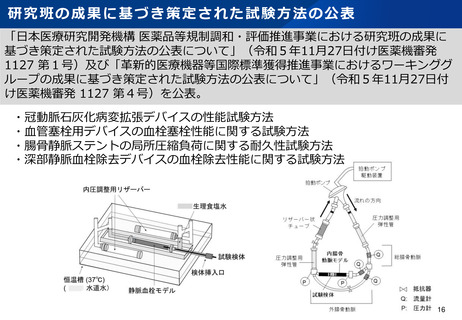
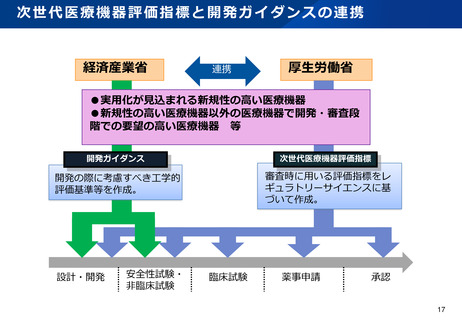
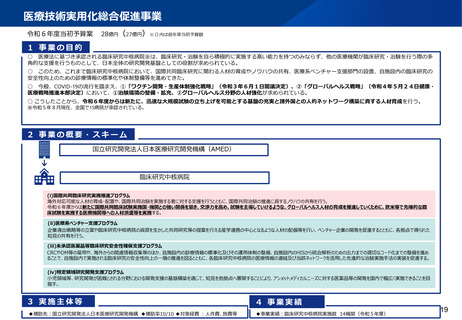
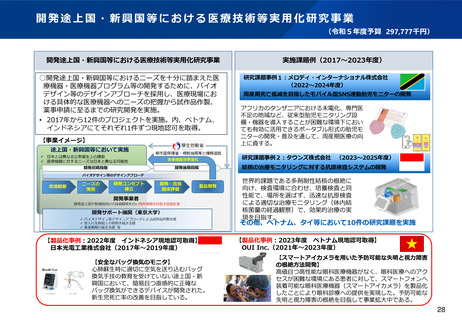
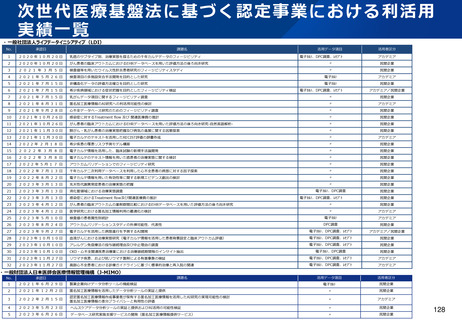
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
プログラム医療機器(SaMD)については、医療現場における利活用について期待が大きい一方で、新たな領域である
ため、効率的な開発の方向性について課題があった。このため、令和2年11月24日にDASH for SaMD(プログラム医療
機器実用化促進パッケージ戦略)を策定し、主として薬事承認を効率的に取得するための制度的な基盤整備を進めた。
今後、 SaMDの更なる実用化促進を図るためには、主として、次の2点を新たに推進する必要がある。
⚫ 薬事部局と保険部局が連携して製品化までの多様な道筋(2段階承認、一般向けSaMD)を明確化し、薬事承認・
保険適用までの予見可能性の確保につなげる。
⚫ 日本発プログラム医療機器の研究開発の加速と国際市場への展開を推進する。
上記を踏まえて、別添のとおり、新たな戦略をとりまとめた。5年後の目標については下記の通りである。
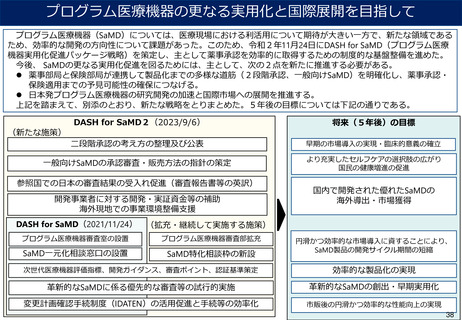
DASH for SaMD2(2023/9/6)
将来(5年後)の目標
二段階承認の考え方の整理及び公表
早期の市場導入の実現・臨床的意義の確立
一般向けSaMDの承認審査・販売方法の指針の策定
より充実したセルフケアの選択肢の広がり
国民の健康増進の促進
(新たな施策)
参照国での日本の審査結果の受入れ促進(審査報告書等の英訳)
開発事業者に対する開発・実証資金等の補助
海外現地での事業環境整備支援
DASH for SaMD(2021/11/24)
(拡充・継続して実施する施策)
プログラム医療機器審査室の設置
プログラム医療機器審査部拡充
SaMD一元化相談窓口の設置
SaMD特化相談枠の新設
国内で開発された優れたSaMDの
海外導出・市場獲得
円滑かつ効率的な市場導入に資することにより、
SaMD製品の開発サイクル期間の短縮
次世代医療機器評価指標、開発ガイダンス、審査ポイント、認証基準策定
効率的な製品化の実現
革新的なSaMDに係る優先的な審査等の試行的実施
革新的なSaMDの創出・早期実用化
変更計画確認手続制度(IDATEN)の活用促進と手続等の効率化
市販後の円滑かつ効率的な性能向上の実現
38