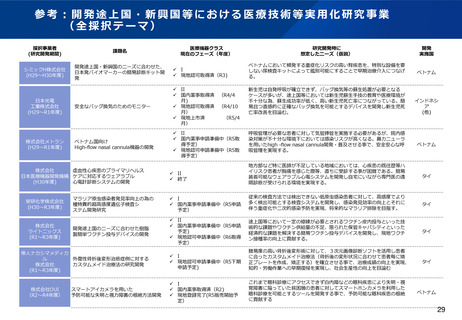
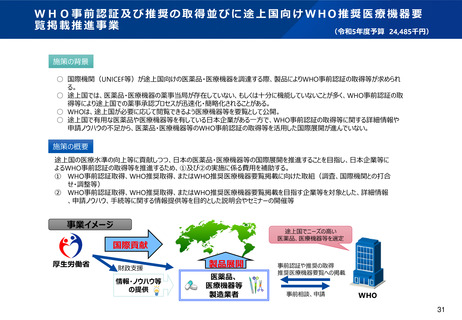
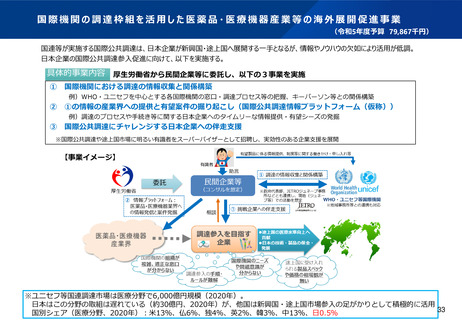
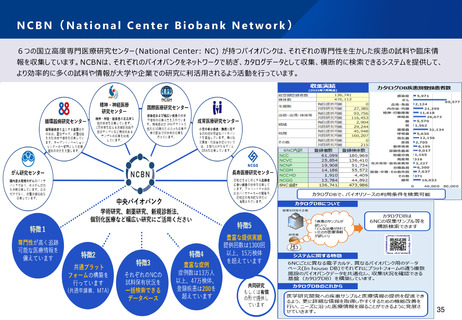
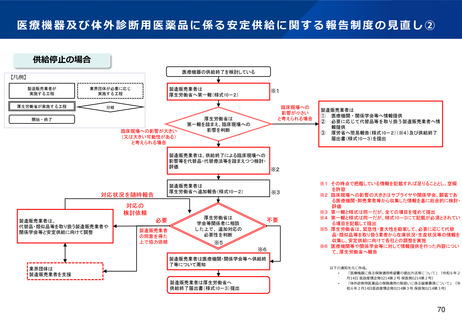
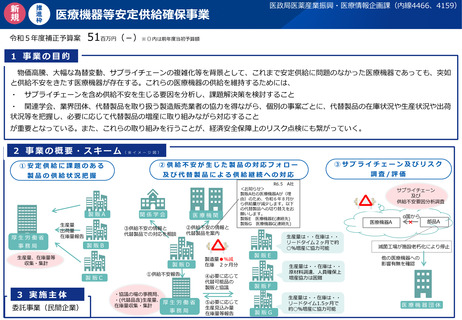
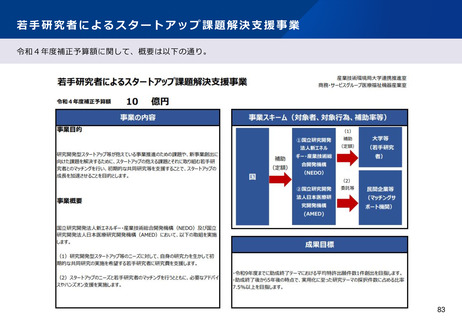
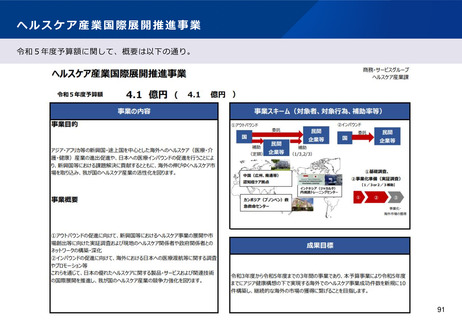
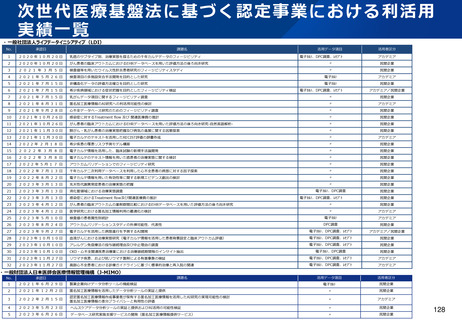
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
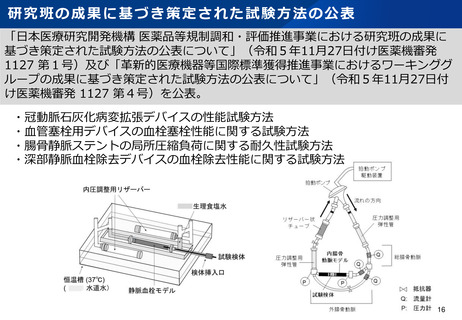
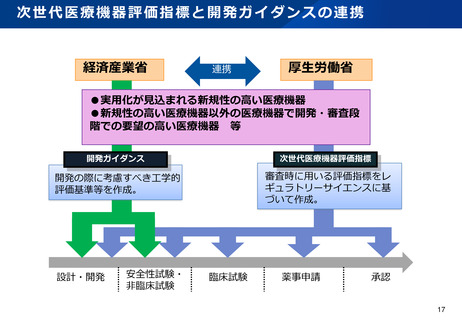
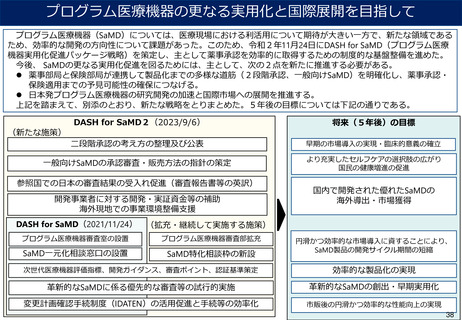
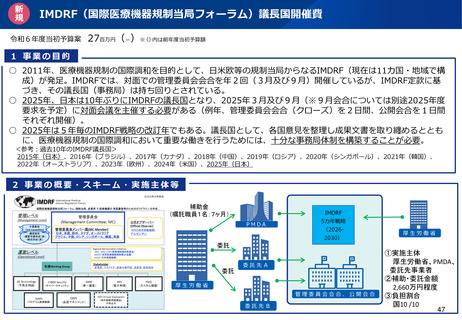
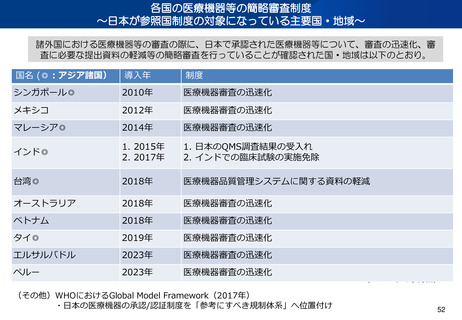
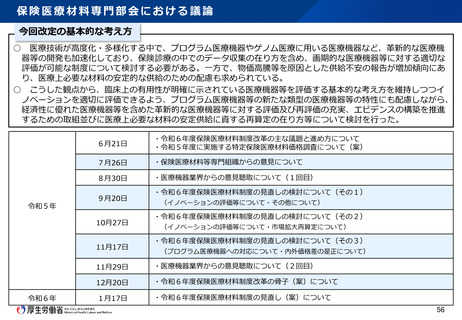
日本発の有効性・安全性の評価方法の確立 及び 国際標準獲得推進事業
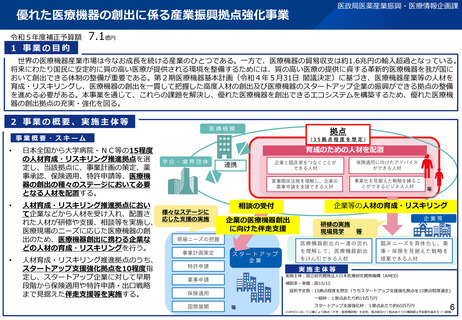
事業目的
日本発の革新的医療機器・再生医療等製品の海外展開が見込まれる分野を中心に、
① 非臨床の段階で有効性・安全性を適切に予測可能な実用的な評価法等を確立
② 確立した評価方法を世界に先駆けて提案し、国際標準を獲得
製品開発、早期実用化を推進するとともに、
海外での承認取得を容易にし、グローバル市場における日本発の製品の普及を推進
検討会
研究機関
国際会議
選定
(アカデミア、業界団体、関係行政機関等)
⚫ 評価方法等の開発
⚫ 戦略の検討、標準獲得を狙う
⚫ 評価方法の多施設検証
助言等
分野の絞り込み
⚫ 技術の分かる専門家として
⚫ 支援する課題の選定
国際会議へ出席
⚫ 進捗の確認・評価
検討会事務局
厚生労働省
国際動向の情報提供等
PMDA
評日
価本
法発
のの
提
案
(機器)
ISO/IEC
技術委員会
(再生医療)
国際シンポジウム等
※ 三年程度で合意形成
国際標準獲得
▼
海外規制での日本発評価法の取込み
▼
日本の製品の海外展開を促進する環境整備
54