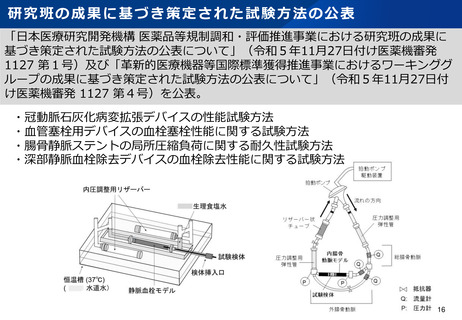
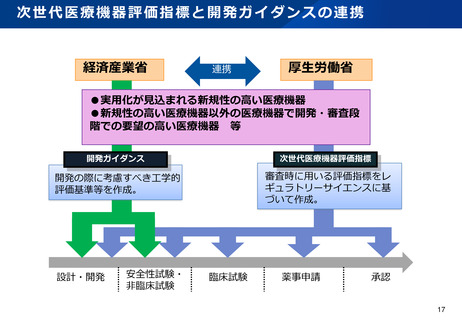
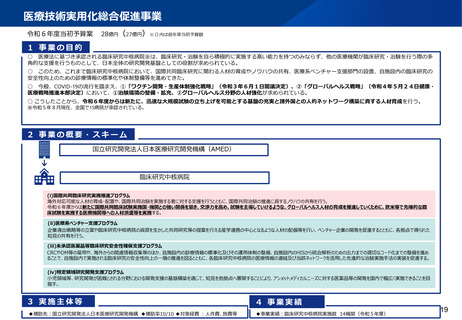
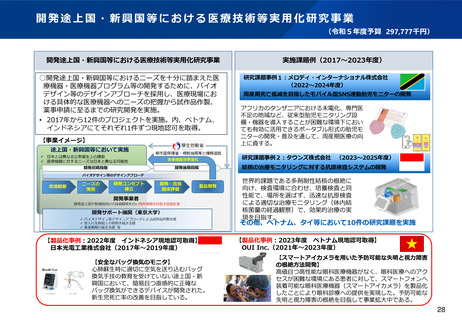
資料2-1 医療機器基本計画に関する各省における取り組みの状況について (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38515.html |
| 出典情報 | 国民が受ける医療の質の向上のための医療機器の研究開発及び普及の促進に関する検討会(第4回 3/12)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
希少疾患等の検査等に対する評価
➢ 希少疾病等の検査に用いる体外診断用医薬品や医療機器について、医薬品や特定保険医療材料に市
場性加算があることも踏まえ、必要な体外診断用医薬品等の開発を評価する観点から、希少疾病用
として薬事上指定された体外診断用医薬品等及び想定される検査回数が少ないコンパニオン診断用
の体外診断用医薬品等を評価する仕組みを新設する。
【希少疾病等の検査に用いるものとして配慮が必要な医療機器等に係る技術料】
○ 以下の(1)又は(2)に該当する場合に、年間想定検査回数に応じた下表の係数を準用技術料に、乗じ
た点数を算定できることとする。
(1) 医薬品医療機器等法第 77 条の2第1項の規定により、希少疾病用医療機器として指定された
医療機器又は体外診断用医薬品による検査
(2) 医薬品の適応判定の補助に必要な検査のうち想定される年間検査回数が1000回未満であるもの
想定年間検査回数
下記以外
希少疾病用として指定された
医療機器等による検査の場合
医薬品の適応判定の補助に
必要な検査の場合
110/100
-
800回以上1,000回未満
110/100
600回以上800回未満
120/100
400回以上600回未満
130/100
200回以上400回未満
140/100
200回未満
150/100
60