よむ、つかう、まなぶ。
参考資料4-4 特例承認医薬品の市販直後調査報告書 (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
◆◇◆◇◆◇◆◇ 本文中の用語について ◇◆◇◆◇◆◇◆
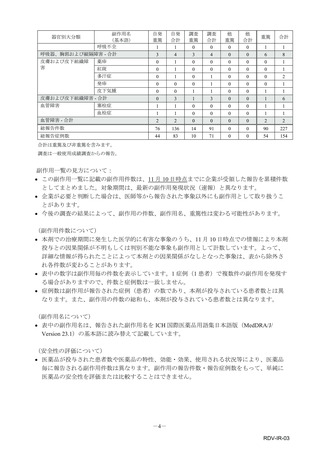
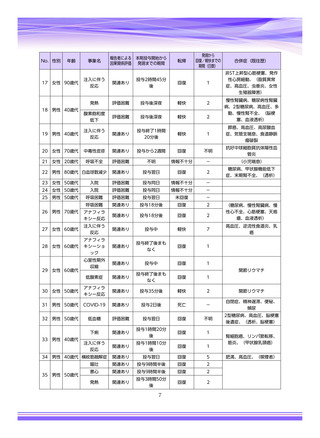
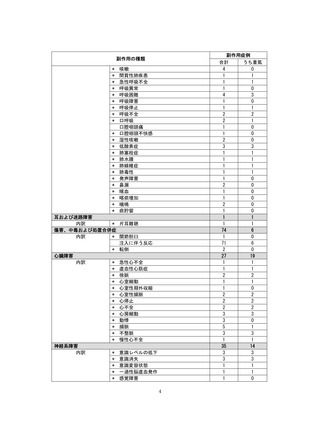
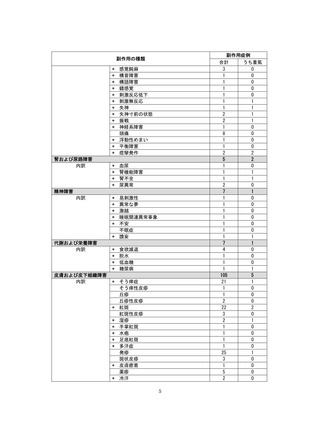
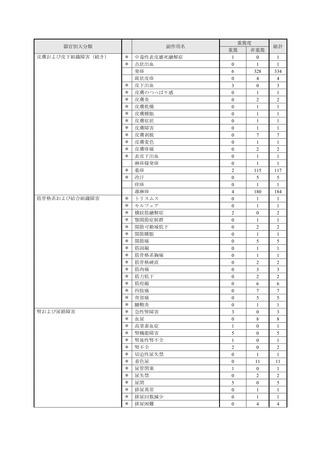
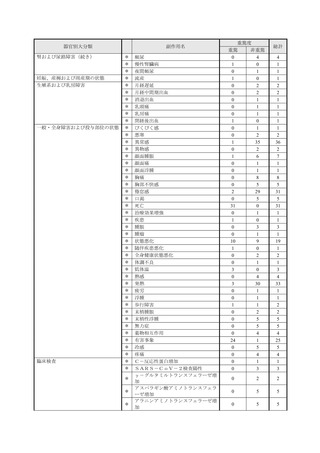
■重篤な副作用の定義
下記については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則」第
228条の20に定められた基準により、重篤な副作用と規定されています。
①
②
③
④
死亡
障害
死亡または障害につながるおそれのある症例
治療のために病院又は診療所への入院又は入院期間の延長が必要とされる症例(③に掲げる事項を
除く)
⑤ 死亡又は②から④までに掲げる症例に準じて重篤である症例
⑥ 後世代における先天性の疾病又は異常
重篤度は医師評価に基づき記載しておりますが、弊社の判断により「重篤」とする場合があります。
■MedDRA(Medical Dictionary for Regulatory Activities)とは
医療に関する国際間の情報交換を迅速かつ的確に行うために、国際的に共通する用語集として医薬品規
制ハーモナイゼイション国際会議(ICH)において作成された、症状、徴候、疾患などに対応する医学
用語集です。
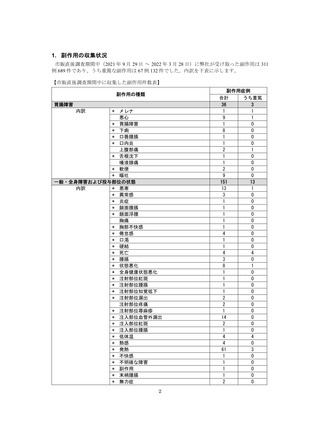
■市販直後調査とは
医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
(平成16年厚生労働省令第135号)に基づき、販売開始後6カ月間、診療において当該医薬品の適正使
用を促し、重篤な副作用等の発生に関する情報を迅速に把握し、その結果をもって保健衛生上の危害の
発生若しくは拡大の防止、又は医薬品の適正な使用の確保のために必要な措置を講ずるために行います。
最新の副作用収集状況及び詳細情報は、弊社ウェブサイトにてご覧いただけます
https://www.chugai-pharm.co.jp/
■症例の詳細情報
特定の患者背景において、最新の副作用件数表、症例一覧、症例詳細情報をご確認いただくことも可
能です。
ご利用に際しましては、利用規約を遵守いただく必要がございますので、内容を十分にご確認ください。
【アクセス方法】
「医療関係者の皆さま」※1→「副作用データベースツール」より、「副作用データベースツールポー
タル」※2をクリック→「がん領域製品以外入口」よりログイン
※1
認証画面が表示されることがあります。その際は対象の職種をお選びいただくか、会員登録済みの方はログイ
※2
会員限定コンテンツのため、medパスへの会員登録が必要となります。
ンを行ってください。
初回アクセス時のみ利用規約が表示されます。
16
2022年6月作成
RON0011.03
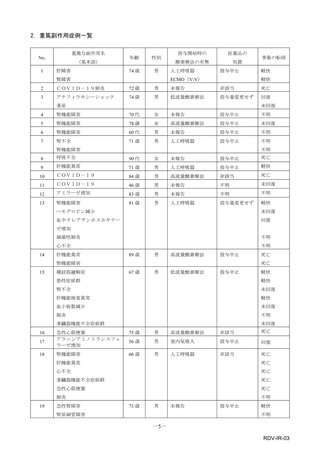
■重篤な副作用の定義
下記については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則」第
228条の20に定められた基準により、重篤な副作用と規定されています。
①
②
③
④
死亡
障害
死亡または障害につながるおそれのある症例
治療のために病院又は診療所への入院又は入院期間の延長が必要とされる症例(③に掲げる事項を
除く)
⑤ 死亡又は②から④までに掲げる症例に準じて重篤である症例
⑥ 後世代における先天性の疾病又は異常
重篤度は医師評価に基づき記載しておりますが、弊社の判断により「重篤」とする場合があります。
■MedDRA(Medical Dictionary for Regulatory Activities)とは
医療に関する国際間の情報交換を迅速かつ的確に行うために、国際的に共通する用語集として医薬品規
制ハーモナイゼイション国際会議(ICH)において作成された、症状、徴候、疾患などに対応する医学
用語集です。
■市販直後調査とは
医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
(平成16年厚生労働省令第135号)に基づき、販売開始後6カ月間、診療において当該医薬品の適正使
用を促し、重篤な副作用等の発生に関する情報を迅速に把握し、その結果をもって保健衛生上の危害の
発生若しくは拡大の防止、又は医薬品の適正な使用の確保のために必要な措置を講ずるために行います。
最新の副作用収集状況及び詳細情報は、弊社ウェブサイトにてご覧いただけます
https://www.chugai-pharm.co.jp/
■症例の詳細情報
特定の患者背景において、最新の副作用件数表、症例一覧、症例詳細情報をご確認いただくことも可
能です。
ご利用に際しましては、利用規約を遵守いただく必要がございますので、内容を十分にご確認ください。
【アクセス方法】
「医療関係者の皆さま」※1→「副作用データベースツール」より、「副作用データベースツールポー
タル」※2をクリック→「がん領域製品以外入口」よりログイン
※1
認証画面が表示されることがあります。その際は対象の職種をお選びいただくか、会員登録済みの方はログイ
※2
会員限定コンテンツのため、medパスへの会員登録が必要となります。
ンを行ってください。
初回アクセス時のみ利用規約が表示されます。
16
2022年6月作成
RON0011.03