よむ、つかう、まなぶ。
参考資料4-4 特例承認医薬品の市販直後調査報告書 (35 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2022 年 7 月
注意―特例承認医薬品
市販直後調査
最終報告
平素は、弊社製品につきまして格別なご高配を賜り、厚く御礼申し上げます。
また、2021 年 9 月 29 日から 2022 年 3 月 28 日を対象期間として実施しておりました
「
」に対する市販直後調査はおかげさまで終了いたしました。市販直後
調査へのご協力を賜り重ねて御礼申し上げます。
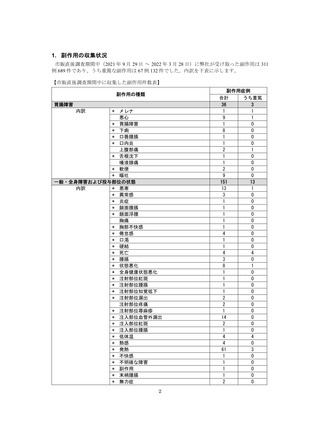
さて、対象期間中に弊社が受け取りました本剤との関連性が否定できない有害事象(以下、副
作用)情報及び本剤使用にあたっての注意点について下記のとおりご報告いたします。
市販直後調査終了後におきましても、本剤を使用される際には、「使用上の注意」にご留意頂
くとともに、本剤の副作用、特に「重篤例」をご経験された場合には、速やかに弊社医薬情報担
当者へご連絡をお願い申し上げます。
記
ゼビュディ点滴静注液 500mg
対象薬剤
市販直後調査期間
2021 年 9 月 29 日 ~ 2022 年 3 月 28 日
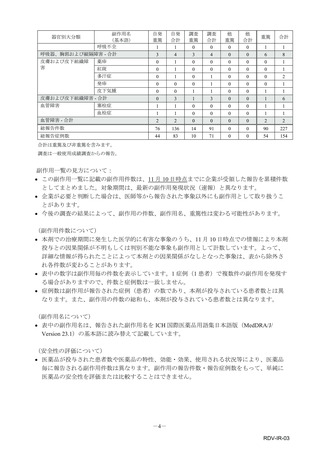
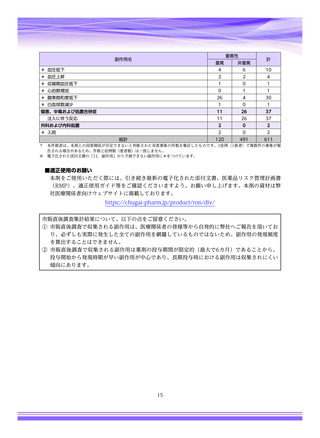
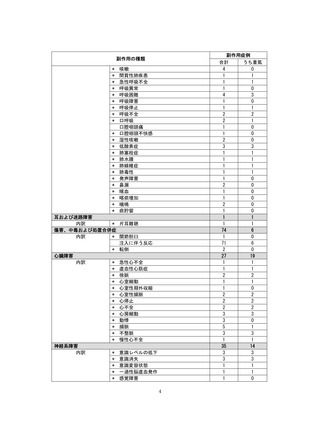
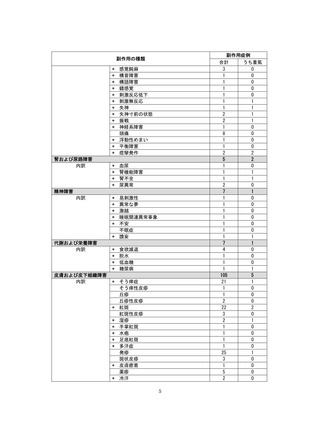
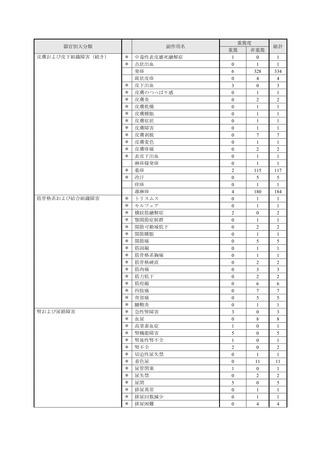
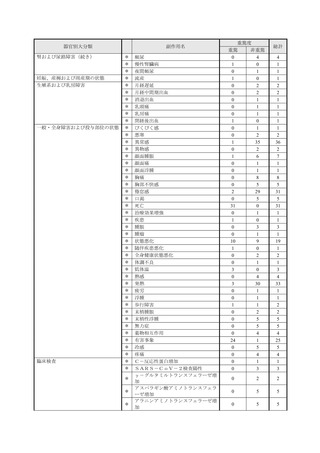
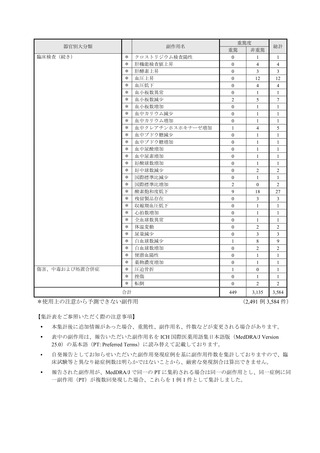
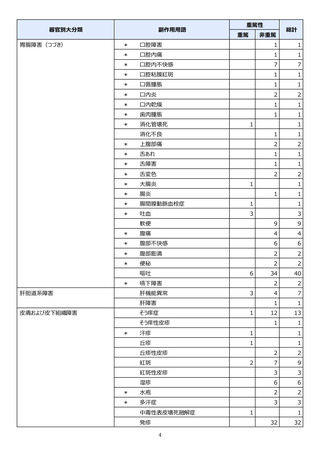
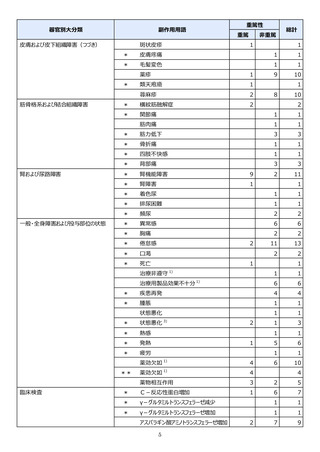
副作用報告症例数注)
311 例 689 件(うち重篤 67 例 132 件)
計 3,535 施設
調査対象医療機関数
病院(20 床以上):3,067 施設
診療所(19 床以下):468 施設
112,695 人
推定使用患者数
注)
:現在調査中の症例を含みますので、今後情報が変更となる可能性がありますことをご了承ください。
《参考:重篤な副作用の定義 》
1.副作用による死亡 2.死亡につながるおそれのある症状(Life-threatening)
3.治療のために入院又は入院期間の延長が必要となる症状 4.障害 5.1~4 に準じて重篤である症状
6.後世代における先天性の疾病又は異常
1
三校 _2022 年 7 月 4 日
注意―特例承認医薬品
市販直後調査
最終報告
平素は、弊社製品につきまして格別なご高配を賜り、厚く御礼申し上げます。
また、2021 年 9 月 29 日から 2022 年 3 月 28 日を対象期間として実施しておりました
「
」に対する市販直後調査はおかげさまで終了いたしました。市販直後
調査へのご協力を賜り重ねて御礼申し上げます。
さて、対象期間中に弊社が受け取りました本剤との関連性が否定できない有害事象(以下、副
作用)情報及び本剤使用にあたっての注意点について下記のとおりご報告いたします。
市販直後調査終了後におきましても、本剤を使用される際には、「使用上の注意」にご留意頂
くとともに、本剤の副作用、特に「重篤例」をご経験された場合には、速やかに弊社医薬情報担
当者へご連絡をお願い申し上げます。
記
ゼビュディ点滴静注液 500mg
対象薬剤
市販直後調査期間
2021 年 9 月 29 日 ~ 2022 年 3 月 28 日
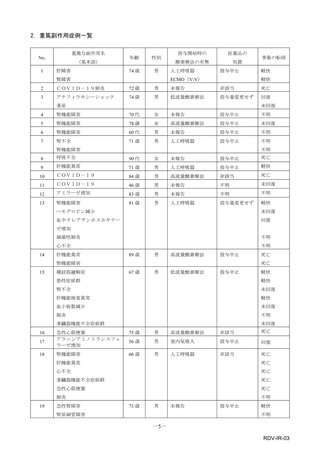
副作用報告症例数注)
311 例 689 件(うち重篤 67 例 132 件)
計 3,535 施設
調査対象医療機関数
病院(20 床以上):3,067 施設
診療所(19 床以下):468 施設
112,695 人
推定使用患者数
注)
:現在調査中の症例を含みますので、今後情報が変更となる可能性がありますことをご了承ください。
《参考:重篤な副作用の定義 》
1.副作用による死亡 2.死亡につながるおそれのある症状(Life-threatening)
3.治療のために入院又は入院期間の延長が必要となる症状 4.障害 5.1~4 に準じて重篤である症状
6.後世代における先天性の疾病又は異常
1
三校 _2022 年 7 月 4 日