よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
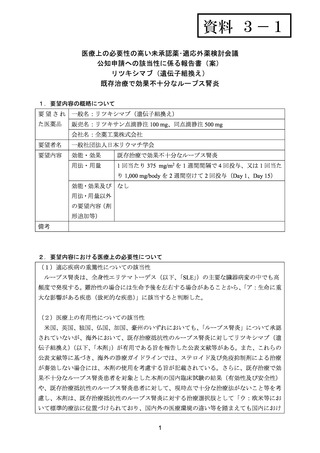
資料 3-1
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
リツキシマブ(遺伝子組換え)
既存治療で効果不十分なループス腎炎
1.要望内容の概略について
要 望 さ れ 一般名:リツキシマブ(遺伝子組換え)
た医薬品
販売名:リツキサン点滴静注 100 mg、同点滴静注 500 mg
会社名:全薬工業株式会社
要望者名
一般社団法人日本リウマチ学会
要望内容
効能・効果
既存治療で効果不十分なループス腎炎
用法・用量
1 回当たり 375 mg/m2 を 1 週間間隔で 4 回投与、又は 1 回当た
り 1,000 mg/body を 2 週間空けて 2 回投与(Day 1、Day 15)
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
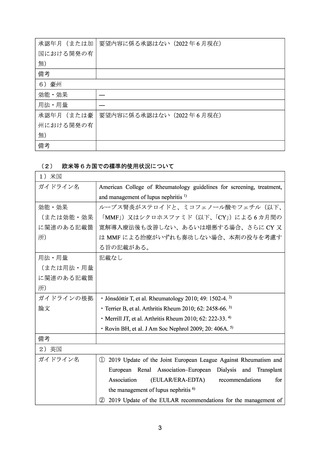
2.要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
ループス腎炎は、全身性エリテマトーデス(以下、「SLE」
)の主要な臓器病変の中でも高
頻度で発現する。難治性の場合には生命予後を左右する場合があることから、
「ア:生命に重
大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
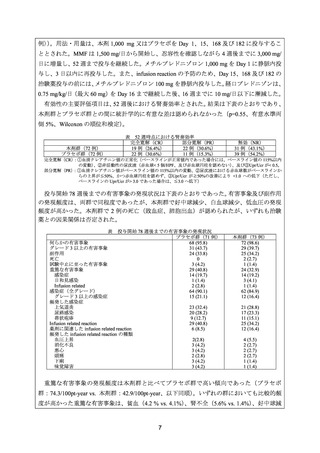
(2)医療上の有用性についての該当性
米国、英国、独国、仏国、加国、豪州のいずれにおいても、
「ループス腎炎」について承認
されていないが、海外において、既存治療抵抗性のループス腎炎に対してリツキシマブ(遺
伝子組換え)
(以下、
「本剤」)が有用である旨を報告した公表文献等がある。また、これらの
公表文献等に基づき、海外の診療ガイドラインでは、ステロイド及び免疫抑制剤による治療
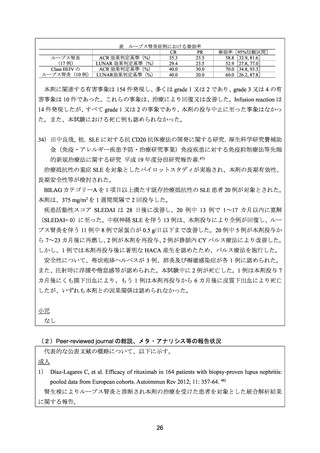
が奏効しない場合には、本剤の使用を考慮する旨が記載されている。さらに、既存治療で効
果不十分なループス腎炎患者を対象とした本剤の国内臨床試験の結果(有効性及び安全性)
や、既存治療抵抗性のループス腎炎患者に対して、現時点で十分な治療法がないこと等を考
慮し、本剤は、既存治療抵抗性のループス腎炎に対する治療選択肢として「ウ:欧米等にお
いて標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内におけ
1
医療上の必要性の高い未承認薬・適応外薬検討会議
公知申請への該当性に係る報告書(案)
リツキシマブ(遺伝子組換え)
既存治療で効果不十分なループス腎炎
1.要望内容の概略について
要 望 さ れ 一般名:リツキシマブ(遺伝子組換え)
た医薬品
販売名:リツキサン点滴静注 100 mg、同点滴静注 500 mg
会社名:全薬工業株式会社
要望者名
一般社団法人日本リウマチ学会
要望内容
効能・効果
既存治療で効果不十分なループス腎炎
用法・用量
1 回当たり 375 mg/m2 を 1 週間間隔で 4 回投与、又は 1 回当た
り 1,000 mg/body を 2 週間空けて 2 回投与(Day 1、Day 15)
効能・効果及び なし
用法・用量以外
の要望内容(剤
形追加等)
備考
2.要望内容における医療上の必要性について
(1)適応疾病の重篤性についての該当性
ループス腎炎は、全身性エリテマトーデス(以下、「SLE」
)の主要な臓器病変の中でも高
頻度で発現する。難治性の場合には生命予後を左右する場合があることから、
「ア:生命に重
大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
(2)医療上の有用性についての該当性
米国、英国、独国、仏国、加国、豪州のいずれにおいても、
「ループス腎炎」について承認
されていないが、海外において、既存治療抵抗性のループス腎炎に対してリツキシマブ(遺
伝子組換え)
(以下、
「本剤」)が有用である旨を報告した公表文献等がある。また、これらの
公表文献等に基づき、海外の診療ガイドラインでは、ステロイド及び免疫抑制剤による治療
が奏効しない場合には、本剤の使用を考慮する旨が記載されている。さらに、既存治療で効
果不十分なループス腎炎患者を対象とした本剤の国内臨床試験の結果(有効性及び安全性)
や、既存治療抵抗性のループス腎炎患者に対して、現時点で十分な治療法がないこと等を考
慮し、本剤は、既存治療抵抗性のループス腎炎に対する治療選択肢として「ウ:欧米等にお
いて標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内におけ
1