よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
ガイドラインの根拠
論文
備考
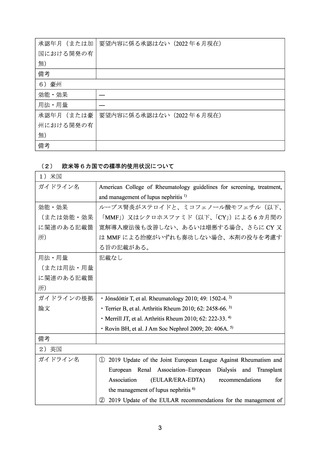
6)豪州
ガイドライン名
なし
効能・効果
(または効能・効果
に関連のある記載箇
所)
用法・用量
(または用法・用量
に関連のある記載箇
所)
ガイドラインの根拠
論文
備考
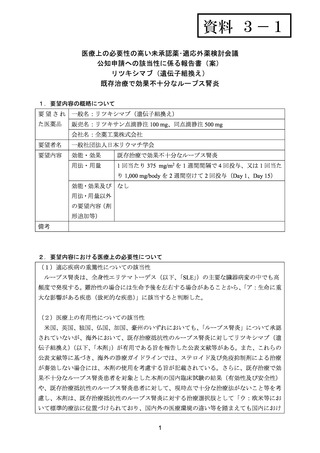
4.要望内容について企業側で実施した海外臨床試験成績について
国内開発企業である全薬工業株式会社により実施された海外臨床試験はない。全薬工業株
式会社の提携企業である米国 Genentech, Inc.,が実施したループス腎炎を対象とした本剤の海
外臨床試験について、以下に試験の概要を示す。
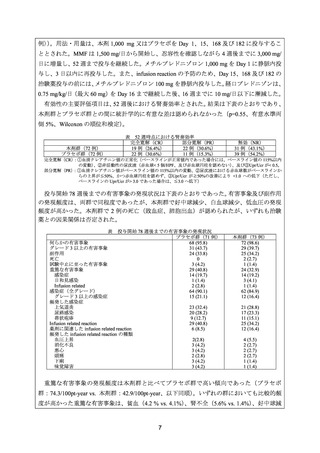
1) Rovin BH, et al. Efficacy and safety of rituximab in patients with active proliferative lupus
nephritis: the Lupus Nephritis Assessment with Rituximab study. Arthritis Rheum 2012; 64:
1215-26. 22)
ステロイド+MMF に本剤を上乗せした場合の有効性及び安全性を検討することを目的と
して、ループス腎炎患者を対象としたプラセボ対照無作為化二重盲検第 III 相試験(LUNAR
試験)が実施された。
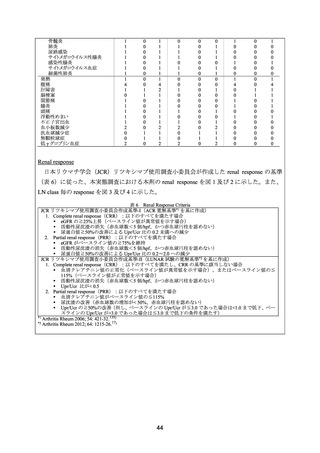
本 試 験 の 対 象 は 、 16 ~ 75 歳 で 、 過 去 12 カ 月 の 腎 生 検 で International Society of
Nephrology/Renal Pathology Society 分類(以下、
「ISN/RPS 分類」
)の 2003 年基準で Class III
又は IV(± V)と診断され、抗核抗体陽性、尿蛋白/尿クレアチニン比(Upr/Ucr)が>1.0 の
ループス腎炎患者とされた。なお、腎生検による組織診断がスクリーニングの 3 カ月以前に
実施された場合には、活動性の尿沈渣所見(赤血球 >10/HPF、又は赤血球円柱)を認めるこ
ととした。50%を超える糸球体硬化症や間質の線維化を認める患者や、糸球体ろ過率の推定
値(eGFR)が 25 mL/min/1.73 m2 未満の患者は除外された。
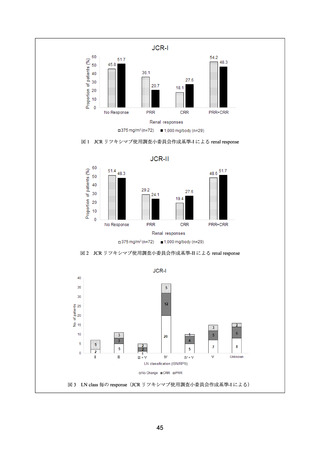
被験者は本剤群又はプラセボ群に 1:1 の割合で無作為に割り付けられた(144 例〈各群 72
6
論文
備考
6)豪州
ガイドライン名
なし
効能・効果
(または効能・効果
に関連のある記載箇
所)
用法・用量
(または用法・用量
に関連のある記載箇
所)
ガイドラインの根拠
論文
備考
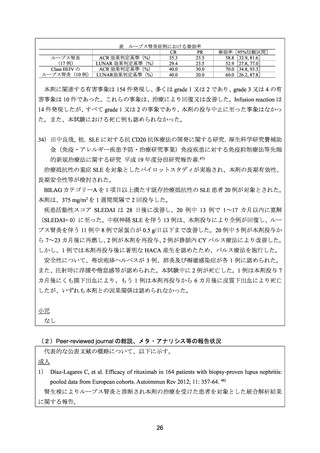
4.要望内容について企業側で実施した海外臨床試験成績について
国内開発企業である全薬工業株式会社により実施された海外臨床試験はない。全薬工業株
式会社の提携企業である米国 Genentech, Inc.,が実施したループス腎炎を対象とした本剤の海
外臨床試験について、以下に試験の概要を示す。
1) Rovin BH, et al. Efficacy and safety of rituximab in patients with active proliferative lupus
nephritis: the Lupus Nephritis Assessment with Rituximab study. Arthritis Rheum 2012; 64:
1215-26. 22)
ステロイド+MMF に本剤を上乗せした場合の有効性及び安全性を検討することを目的と
して、ループス腎炎患者を対象としたプラセボ対照無作為化二重盲検第 III 相試験(LUNAR
試験)が実施された。
本 試 験 の 対 象 は 、 16 ~ 75 歳 で 、 過 去 12 カ 月 の 腎 生 検 で International Society of
Nephrology/Renal Pathology Society 分類(以下、
「ISN/RPS 分類」
)の 2003 年基準で Class III
又は IV(± V)と診断され、抗核抗体陽性、尿蛋白/尿クレアチニン比(Upr/Ucr)が>1.0 の
ループス腎炎患者とされた。なお、腎生検による組織診断がスクリーニングの 3 カ月以前に
実施された場合には、活動性の尿沈渣所見(赤血球 >10/HPF、又は赤血球円柱)を認めるこ
ととした。50%を超える糸球体硬化症や間質の線維化を認める患者や、糸球体ろ過率の推定
値(eGFR)が 25 mL/min/1.73 m2 未満の患者は除外された。
被験者は本剤群又はプラセボ群に 1:1 の割合で無作為に割り付けられた(144 例〈各群 72
6