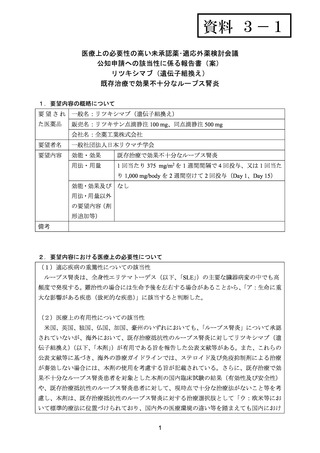
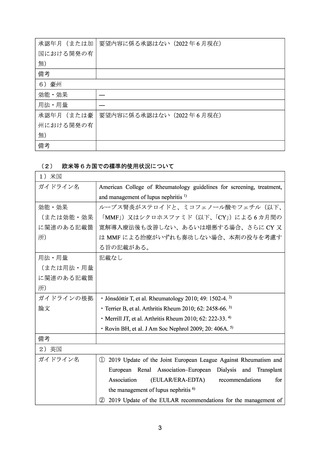
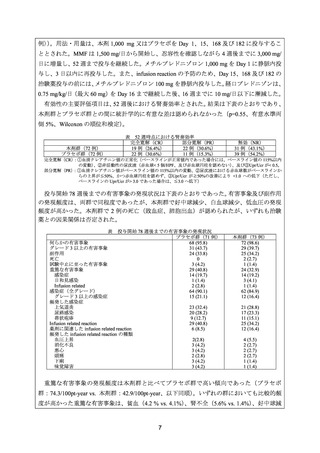
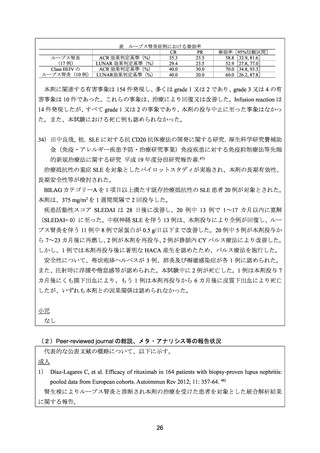
よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
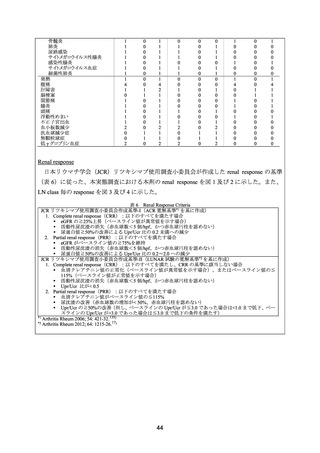
リシスを実施した。
ループス腎炎に関する主な結果の概要を以下に示す。
難治性ループス腎炎に関する研究報告が 10 報(計 223 例)含まれた。
本剤の用量は研究報告によって異なり、375 mg/m2 を 4 回投与、500 又は 1,000 mg を 2 回
投与等であった。
安全性について、最も一般的な副作用は感染症(尿路又は呼吸器)
、infusion reaction、敗
血症様症候群、血小板減少症、血清病様反応であった。水痘肺炎による死亡が 1 例、敗
血症による死亡が 1 例、MRSA 感染症が 1 例に報告された。
有効性について、CR は、ループス腎炎及び SLE でそれぞれ 51%及び 46%であり、PR は、
ループス腎炎及び SLE でそれぞれ 27%及び 34%であった。
8) Iaccarino L, et al. Efficacy and safety of off-label use of rituximab in refractory lupus: data from
the Italian Multicentre Registry. Clin Exp Rheumatol 2015; 33: 449-56. 52)
本剤の SLE に対する有効性及び安全性について評価するため、レジストリ研究が実施され
た。
2003 年 5 月から 2012 年 8 月までに、イタリアの 11 施設から 145 例の SLE 患者のデータが
収集された。全症例が ACR の SLE 改訂基準に従って分類され、SLE の難治性症状の定義は
他の欧州レジストリと同様に医師判断に基づき行われた。本剤は、1 種類以上の免疫抑制剤
が無効で、免疫抑制剤に追加又は置き換えて投与された。
本剤のレジメンは、1,000 mg を 2 週間間隔で 2 回投与(A)
、375 mg/m2 を 1 週間間隔で 4
回投与(B)
、375 mg/m2 を 1 週間間隔で 4 回投与し、4 回目投与の 1 及び 2 カ月後に 2 回投与
(C)の 3 種類が用いられた。C のレジメンでは、CY 750 mg のパルスを 2 回(Day 4 及び 17)、
メチルプレドニゾロン 15 mg/kg のパルスを 3 回(Day 1、4 及び 8)施行した。
ループス腎炎に関する主な結果の概要を以下に示す。
ループス腎炎は 68 例であり、尿蛋白及び血清クレアチニン値(平均値±標準偏差)は 4.04
±2.91 g/日及び 1.09±0.63 mg/日であった。
SLE 患者 145 例について、本剤のレジメンは A:118 例(81.4%)
、B:17 例(11.7%)、C:
10 例(6.9%)であった。59 例で 2 回目の治療コースを実施し、18 例で 3 回目の治療コ
ースを実施した。全ての治療コースを含む追跡期間(平均値±標準偏差)は 27.3±18.5
カ月(範囲:6~84 カ月)であった。
本剤を免疫抑制剤に併用した症例は 110 例(75.9%)であった。抗マラリア薬併用例は
34 例(23.4%)
、経口ステロイド併用例は 130 例(89.7%)
、静注メチルプレドニゾロン(500、
750 又は 1,000 mg)併用例は 13 例(8.9%)であった。
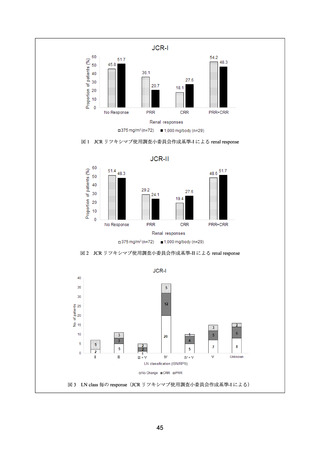
ループス腎炎患者 68 例において、12 カ月後に腎奏効(CR 又は PR)は 64 例(94.l%)で
認められ、そのうち CR は 21 例(30.9%)であった。腎の CR 及び PR は、EULAR によ
るループス腎炎の診療に関するリコメンデーションに従って定義された。
本剤の最終投与から 19.6±21.7 カ月(範囲:6~73 カ月)
で、
腎奏効例 64 例中 20 例
(31.2%)
31
ループス腎炎に関する主な結果の概要を以下に示す。
難治性ループス腎炎に関する研究報告が 10 報(計 223 例)含まれた。
本剤の用量は研究報告によって異なり、375 mg/m2 を 4 回投与、500 又は 1,000 mg を 2 回
投与等であった。
安全性について、最も一般的な副作用は感染症(尿路又は呼吸器)
、infusion reaction、敗
血症様症候群、血小板減少症、血清病様反応であった。水痘肺炎による死亡が 1 例、敗
血症による死亡が 1 例、MRSA 感染症が 1 例に報告された。
有効性について、CR は、ループス腎炎及び SLE でそれぞれ 51%及び 46%であり、PR は、
ループス腎炎及び SLE でそれぞれ 27%及び 34%であった。
8) Iaccarino L, et al. Efficacy and safety of off-label use of rituximab in refractory lupus: data from
the Italian Multicentre Registry. Clin Exp Rheumatol 2015; 33: 449-56. 52)
本剤の SLE に対する有効性及び安全性について評価するため、レジストリ研究が実施され
た。
2003 年 5 月から 2012 年 8 月までに、イタリアの 11 施設から 145 例の SLE 患者のデータが
収集された。全症例が ACR の SLE 改訂基準に従って分類され、SLE の難治性症状の定義は
他の欧州レジストリと同様に医師判断に基づき行われた。本剤は、1 種類以上の免疫抑制剤
が無効で、免疫抑制剤に追加又は置き換えて投与された。
本剤のレジメンは、1,000 mg を 2 週間間隔で 2 回投与(A)
、375 mg/m2 を 1 週間間隔で 4
回投与(B)
、375 mg/m2 を 1 週間間隔で 4 回投与し、4 回目投与の 1 及び 2 カ月後に 2 回投与
(C)の 3 種類が用いられた。C のレジメンでは、CY 750 mg のパルスを 2 回(Day 4 及び 17)、
メチルプレドニゾロン 15 mg/kg のパルスを 3 回(Day 1、4 及び 8)施行した。
ループス腎炎に関する主な結果の概要を以下に示す。
ループス腎炎は 68 例であり、尿蛋白及び血清クレアチニン値(平均値±標準偏差)は 4.04
±2.91 g/日及び 1.09±0.63 mg/日であった。
SLE 患者 145 例について、本剤のレジメンは A:118 例(81.4%)
、B:17 例(11.7%)、C:
10 例(6.9%)であった。59 例で 2 回目の治療コースを実施し、18 例で 3 回目の治療コ
ースを実施した。全ての治療コースを含む追跡期間(平均値±標準偏差)は 27.3±18.5
カ月(範囲:6~84 カ月)であった。
本剤を免疫抑制剤に併用した症例は 110 例(75.9%)であった。抗マラリア薬併用例は
34 例(23.4%)
、経口ステロイド併用例は 130 例(89.7%)
、静注メチルプレドニゾロン(500、
750 又は 1,000 mg)併用例は 13 例(8.9%)であった。
ループス腎炎患者 68 例において、12 カ月後に腎奏効(CR 又は PR)は 64 例(94.l%)で
認められ、そのうち CR は 21 例(30.9%)であった。腎の CR 及び PR は、EULAR によ
るループス腎炎の診療に関するリコメンデーションに従って定義された。
本剤の最終投与から 19.6±21.7 カ月(範囲:6~73 カ月)
で、
腎奏効例 64 例中 20 例
(31.2%)
31