よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (41 ページ)
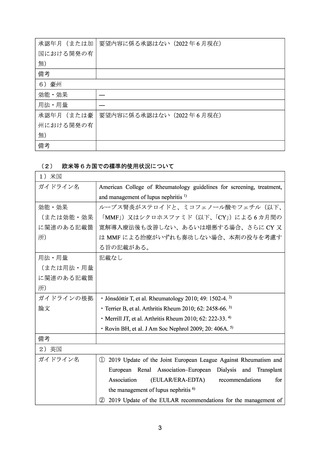
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
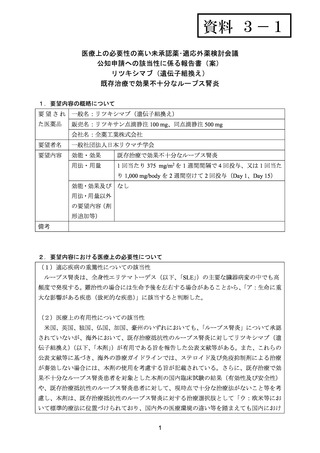
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において、現在までにループス腎炎に対する本剤の開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
1) Iwata S, et al. Efficacy and Safety of anti-CD20 antibody rituximab for patients with refractory
systemic lupus erythematosus. Lupus 2018; 27: 802-11. 62)
産業医科大学にて難治性 SLE と診断され本剤を投与された 63 例に関する後方視的研究報
告。年齢は 16~68 歳、罹患期間 87.2 カ月、ステロイドは全例に使用され、26 例で中枢神経
病変(NPSLE)、38 例でループス腎炎を合併していた。34 例で CY 大量間歇静注療法の治療
歴を有していた。本剤は 500 mg/回を 1 週間間隔で 2 回若しくは 4 回、又は 1,000 mg/回を 2
回(day 1 及び 15)若しくは 4 回(day 1、15、168 及び 182)投与した。
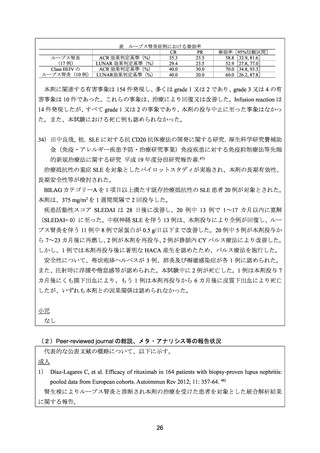
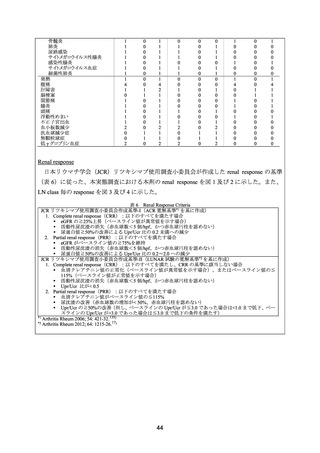
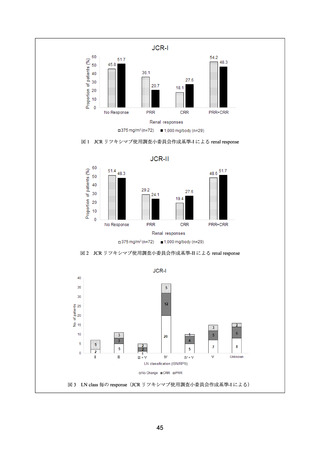
主要評価項目として 1 年後の BILAG 反応性を検討した結果、60 例が評価可能(3 例が追跡
不能)であり、高反応例 36 例(60%)、中反応例 15 例(25%)であった。ループス腎炎に対
する効果は、1 年後に評価可能であった 36 例中 30 例(83.3%)で、BILAG A 又は B から C
又は D に改善した。また、1 年後に Upr/Ucr 比は低下していた。
安全性について、1 年後までに有害事象が 65 件認められた。感染症は 15 件認められたが、
いずれも治療により回復した。1 例が脳出血により死亡したが、本剤との因果関係は否定的で
あった。
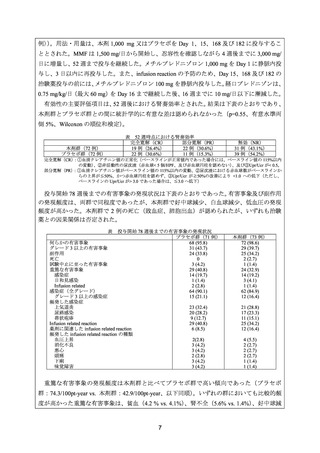
2) Tanaka Y, et al. Rituximab in the Real-World Treatment of Lupus Nephritis: A Retrospective
Cohort Study in Japan. Mod Rheumatol 2022 Feb 15: roac007. doi: 10.1093/mr/roac007 63)
日本リウマチ学会、日本腎臓学会、日本小児リウマチ学会、日本小児腎臓病学会. ループ
ス腎炎に対するリツキシマブ(遺伝子組換え)使用に関するステートメント(2022 年 2
月 18 日 第 1 版)61)
日本リウマチ学会、日本腎臓学会、日本小児リウマチ学会及び日本小児腎臓病学会により、
国内 47 施設を対象に実施されたループス腎炎に対する国内使用実態調査(以下、
「国内使用
実態調査」
)の結果は以下のとおりであった。
患者背景
1) 対象
ループス腎炎の治療の目的で本剤が投与された患者が 26 施設から 115 例登録された。
2) 年齢
平均値±標準偏差:34.7 ± 13.1 歳、中央値(範囲)
:34.0 歳(11~69 歳)
3) 組織型分類(ISN/PRS 分類)
41
(1)要望内容に係る本邦での開発状況(経緯)等について
本邦において、現在までにループス腎炎に対する本剤の開発は行われていない。
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
1) Iwata S, et al. Efficacy and Safety of anti-CD20 antibody rituximab for patients with refractory
systemic lupus erythematosus. Lupus 2018; 27: 802-11. 62)
産業医科大学にて難治性 SLE と診断され本剤を投与された 63 例に関する後方視的研究報
告。年齢は 16~68 歳、罹患期間 87.2 カ月、ステロイドは全例に使用され、26 例で中枢神経
病変(NPSLE)、38 例でループス腎炎を合併していた。34 例で CY 大量間歇静注療法の治療
歴を有していた。本剤は 500 mg/回を 1 週間間隔で 2 回若しくは 4 回、又は 1,000 mg/回を 2
回(day 1 及び 15)若しくは 4 回(day 1、15、168 及び 182)投与した。
主要評価項目として 1 年後の BILAG 反応性を検討した結果、60 例が評価可能(3 例が追跡
不能)であり、高反応例 36 例(60%)、中反応例 15 例(25%)であった。ループス腎炎に対
する効果は、1 年後に評価可能であった 36 例中 30 例(83.3%)で、BILAG A 又は B から C
又は D に改善した。また、1 年後に Upr/Ucr 比は低下していた。
安全性について、1 年後までに有害事象が 65 件認められた。感染症は 15 件認められたが、
いずれも治療により回復した。1 例が脳出血により死亡したが、本剤との因果関係は否定的で
あった。
2) Tanaka Y, et al. Rituximab in the Real-World Treatment of Lupus Nephritis: A Retrospective
Cohort Study in Japan. Mod Rheumatol 2022 Feb 15: roac007. doi: 10.1093/mr/roac007 63)
日本リウマチ学会、日本腎臓学会、日本小児リウマチ学会、日本小児腎臓病学会. ループ
ス腎炎に対するリツキシマブ(遺伝子組換え)使用に関するステートメント(2022 年 2
月 18 日 第 1 版)61)
日本リウマチ学会、日本腎臓学会、日本小児リウマチ学会及び日本小児腎臓病学会により、
国内 47 施設を対象に実施されたループス腎炎に対する国内使用実態調査(以下、
「国内使用
実態調査」
)の結果は以下のとおりであった。
患者背景
1) 対象
ループス腎炎の治療の目的で本剤が投与された患者が 26 施設から 115 例登録された。
2) 年齢
平均値±標準偏差:34.7 ± 13.1 歳、中央値(範囲)
:34.0 歳(11~69 歳)
3) 組織型分類(ISN/PRS 分類)
41