よむ、つかう、まなぶ。
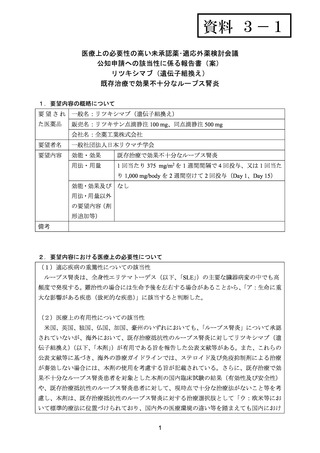
資料3-1 リツキシマブ(遺伝子組換え) (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
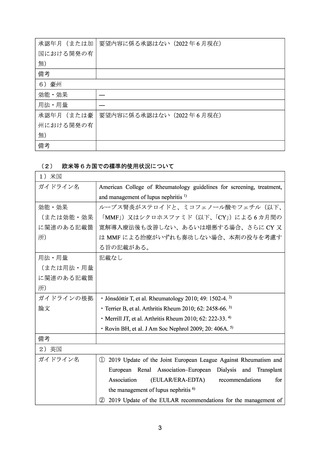
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
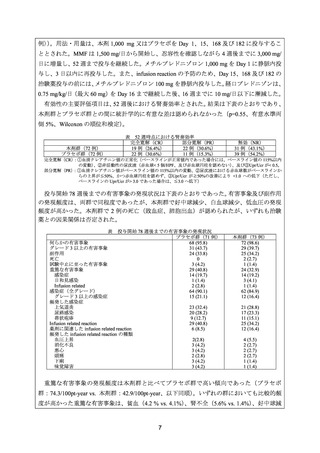
2) Terrier B, et al. Safety and efficacy of rituximab in systemic lupus erythematosus: results from
136 patients from the French AutoImmunity and Rituximab registry. Arthritis Rheum 2010; 62:
2458-66. 3)
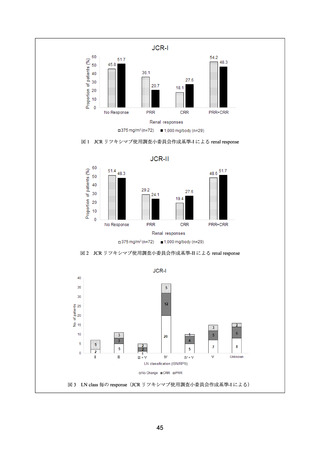
2005 年 9 月から 2009 年 6 月までに 44 施設から SLE 患者 136 例が French Autoimmunity and
Rituximab レジストリに登録された。SLE 患者 136 例のうち、腎疾患合併例は 42 例であり、
そのうち ISN/RPS 基準に基づき腎生検によりループス腎炎と診断された症例は 40 例(Class
IV:22 例、Class III:8 例、Class V:4 例、Class II:2 例、Class III+IV:2 例、Class III+V:1
例、Class IV+V:1 例)であった。腎疾患合併例 42 例のうち、MMF 抵抗例は 28 例(67%)
、
CY 抵抗例は 26 例(62%)であり、前治療として MMF 又は CY を投与していない症例は 10
例(24%)のみであった。
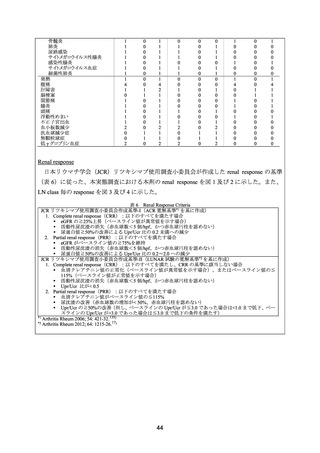
本剤の有効性は、3 カ月以上の観察が可能であった症例を対象に評価した。CR は、尿蛋白
が 0.5 g/日未満、血尿消失及び eGFR 正常化と定義し、PR は、ベースライン時に異常の認め
られた血清クレアチニン値及び尿蛋白が 50%以上改善した場合と定義した。
ループス腎炎の症例で解析対象となった 31 例中 23 例(74%)に奏効(CR 又は PR)が認
められ、CR は 14 例(45%)、PR は 9 例(29%)であった。ループス腎炎に対して本剤を投与
した 5 例で再燃が認められた。
安全性について、ループス腎炎に対して本剤と高用量のステロイドを投与した 1 例が、重
篤な感染症により死亡した。
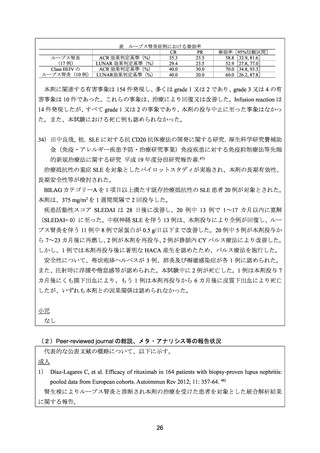
3) Ramos-Casals M, et al. Rituximab in systemic lupus erythematosus: A systematic review of
off-label use in 188 cases. Lupus 2009; 18: 767-76. 49)
2002 年 1 月から 2007 年 12 月までの PubMed データベースに対して、
“rituximab”、
“anti-CD20”
及び“systemic lupus erythematosus”のキーワードで検索し、
学会抄録や総説等を除いた 35 報
(単
群試験 9 報、症例報告 26 報)を選択し、本剤により治療された SLE 患者 188 例を対象とし
た。103 例(55%)がループス腎炎であった。
本剤の主な投与目的は、ステロイド及び免疫抑制剤に抵抗性を示し、多臓器に障害を有す
る活動性 SLE 患者の治療であり、105 例(56%)が CY による前治療歴を有していた。
本剤の主な用法・用量は、375 mg/m2 を 1 週間間隔で 4 回投与(73 例〈39%〉)
、1,000 mg
を 15 日間隔で 2 回投与(35 例〈19%〉
)であった。全例でステロイドを併用しており、58 例
(31%)が導入期にメチルプレドニゾロン静注を併用していた。また、97 例(52%)で CY
静注を、41 例(22%)でメチルプレドニゾロン静注と CY を併用していた。
ループス腎炎 103 例における奏効率は 91%(94 例)であった。組織型分類別の奏効率は、
Class III:91%(10/11 例)、Class IV:96%(55/57 例)
、Class V:100%(4/4 例)
、組織型分類
不可:89%(25/31 例)であった。効果が認められなかった症例は 9 例(Class III:2 例、Class
IV:1 例、組織型分類不可:6 例)であった。
安全性について、SLE 患者 188 例を対象に解析され、有害事象は 44 例(23%)に認められ
28
136 patients from the French AutoImmunity and Rituximab registry. Arthritis Rheum 2010; 62:
2458-66. 3)
2005 年 9 月から 2009 年 6 月までに 44 施設から SLE 患者 136 例が French Autoimmunity and
Rituximab レジストリに登録された。SLE 患者 136 例のうち、腎疾患合併例は 42 例であり、
そのうち ISN/RPS 基準に基づき腎生検によりループス腎炎と診断された症例は 40 例(Class
IV:22 例、Class III:8 例、Class V:4 例、Class II:2 例、Class III+IV:2 例、Class III+V:1
例、Class IV+V:1 例)であった。腎疾患合併例 42 例のうち、MMF 抵抗例は 28 例(67%)
、
CY 抵抗例は 26 例(62%)であり、前治療として MMF 又は CY を投与していない症例は 10
例(24%)のみであった。
本剤の有効性は、3 カ月以上の観察が可能であった症例を対象に評価した。CR は、尿蛋白
が 0.5 g/日未満、血尿消失及び eGFR 正常化と定義し、PR は、ベースライン時に異常の認め
られた血清クレアチニン値及び尿蛋白が 50%以上改善した場合と定義した。
ループス腎炎の症例で解析対象となった 31 例中 23 例(74%)に奏効(CR 又は PR)が認
められ、CR は 14 例(45%)、PR は 9 例(29%)であった。ループス腎炎に対して本剤を投与
した 5 例で再燃が認められた。
安全性について、ループス腎炎に対して本剤と高用量のステロイドを投与した 1 例が、重
篤な感染症により死亡した。
3) Ramos-Casals M, et al. Rituximab in systemic lupus erythematosus: A systematic review of
off-label use in 188 cases. Lupus 2009; 18: 767-76. 49)
2002 年 1 月から 2007 年 12 月までの PubMed データベースに対して、
“rituximab”、
“anti-CD20”
及び“systemic lupus erythematosus”のキーワードで検索し、
学会抄録や総説等を除いた 35 報
(単
群試験 9 報、症例報告 26 報)を選択し、本剤により治療された SLE 患者 188 例を対象とし
た。103 例(55%)がループス腎炎であった。
本剤の主な投与目的は、ステロイド及び免疫抑制剤に抵抗性を示し、多臓器に障害を有す
る活動性 SLE 患者の治療であり、105 例(56%)が CY による前治療歴を有していた。
本剤の主な用法・用量は、375 mg/m2 を 1 週間間隔で 4 回投与(73 例〈39%〉)
、1,000 mg
を 15 日間隔で 2 回投与(35 例〈19%〉
)であった。全例でステロイドを併用しており、58 例
(31%)が導入期にメチルプレドニゾロン静注を併用していた。また、97 例(52%)で CY
静注を、41 例(22%)でメチルプレドニゾロン静注と CY を併用していた。
ループス腎炎 103 例における奏効率は 91%(94 例)であった。組織型分類別の奏効率は、
Class III:91%(10/11 例)、Class IV:96%(55/57 例)
、Class V:100%(4/4 例)
、組織型分類
不可:89%(25/31 例)であった。効果が認められなかった症例は 9 例(Class III:2 例、Class
IV:1 例、組織型分類不可:6 例)であった。
安全性について、SLE 患者 188 例を対象に解析され、有害事象は 44 例(23%)に認められ
28