よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
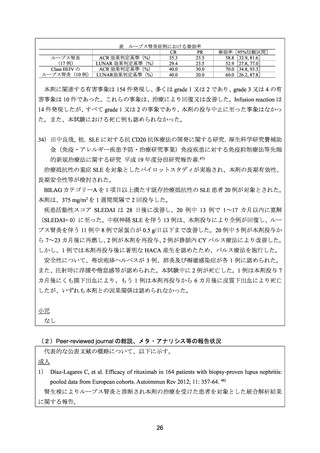
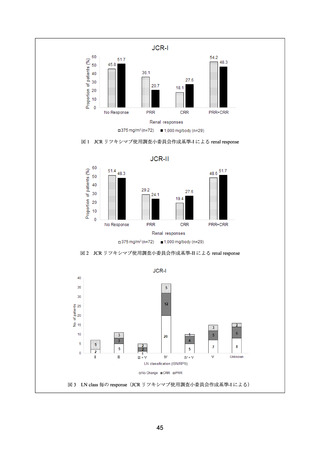
図4
LN class 毎の response(JCR リツキシマブ使用調査小委員会作成基準-II による)
小児例(7 歳以上 15 歳未満)
今回調査対象とした計 115 例には小児例 3 例が含まれており、その詳細を表 7 に示した。
表7
年齢
(歳)
性別
小児報告例一覧
有効性*1
本剤の用法・用量
安全性
1 回当たり 500 mg/body を 1
基準 I:NR
副作用として帯状疱疹を認め
症例 1
11
男
週間間隔で 2 回投与
基準 II:NR
たが、回復が確認されている。
1 回当たり 375 mg/m2 を 1 週間 基準 I:PR
症例 2
14
女
副作用は認められなかった。
間隔で 2 回投与
基準 II:NR
2
1 回当たり 375 mg/m を 1 週間 基準 I:NE
症例 3
11
女
副作用は認められなかった。
間隔で 4 回投与
基準 II:NE
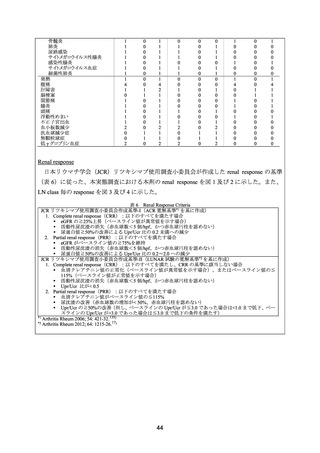
*1 JCR リツキシマブ使用調査小委員会作成基準による renal response(表 6 参照)。
NE:not evaluable、NR:no response、PR:partial response
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外で実施されたループス腎炎患者を対象としたプラセボ対照無作為化二重盲検第 III 相
試験(LUNAR 試験)において、本剤のプラセボに対する有効性が示されなかったことから、
本剤はループス腎炎に対する一次治療としては推奨されていないものの、既存治療で効果不
十分な成人及び小児のループス腎炎に対する本剤の有用性が国内外で報告されており、海外
の診療ガイドラインでは、ステロイドや免疫抑制剤による治療が奏功しない場合には本剤の
投与を考慮する旨が記載されている。また、国内使用実態調査において本剤の既存治療で効
果不十分なループス腎炎に対する使用実態が確認され、当該調査結果を踏まえた「ループス
腎炎に対するリツキシマブ(遺伝子組換え)使用に関するステートメント」(以下、
「国内ス
テートメント」
)が公表されている。また、海外の診療ガイドラインでは、小児に対して成人
と同様の治療を行う旨が記載されており、国内使用実態調査においても小児に対する投与経
46
LN class 毎の response(JCR リツキシマブ使用調査小委員会作成基準-II による)
小児例(7 歳以上 15 歳未満)
今回調査対象とした計 115 例には小児例 3 例が含まれており、その詳細を表 7 に示した。
表7
年齢
(歳)
性別
小児報告例一覧
有効性*1
本剤の用法・用量
安全性
1 回当たり 500 mg/body を 1
基準 I:NR
副作用として帯状疱疹を認め
症例 1
11
男
週間間隔で 2 回投与
基準 II:NR
たが、回復が確認されている。
1 回当たり 375 mg/m2 を 1 週間 基準 I:PR
症例 2
14
女
副作用は認められなかった。
間隔で 2 回投与
基準 II:NR
2
1 回当たり 375 mg/m を 1 週間 基準 I:NE
症例 3
11
女
副作用は認められなかった。
間隔で 4 回投与
基準 II:NE
*1 JCR リツキシマブ使用調査小委員会作成基準による renal response(表 6 参照)。
NE:not evaluable、NR:no response、PR:partial response
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
海外で実施されたループス腎炎患者を対象としたプラセボ対照無作為化二重盲検第 III 相
試験(LUNAR 試験)において、本剤のプラセボに対する有効性が示されなかったことから、
本剤はループス腎炎に対する一次治療としては推奨されていないものの、既存治療で効果不
十分な成人及び小児のループス腎炎に対する本剤の有用性が国内外で報告されており、海外
の診療ガイドラインでは、ステロイドや免疫抑制剤による治療が奏功しない場合には本剤の
投与を考慮する旨が記載されている。また、国内使用実態調査において本剤の既存治療で効
果不十分なループス腎炎に対する使用実態が確認され、当該調査結果を踏まえた「ループス
腎炎に対するリツキシマブ(遺伝子組換え)使用に関するステートメント」(以下、
「国内ス
テートメント」
)が公表されている。また、海外の診療ガイドラインでは、小児に対して成人
と同様の治療を行う旨が記載されており、国内使用実態調査においても小児に対する投与経
46