よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
表
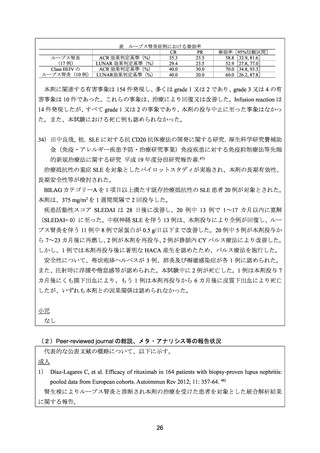
ループス腎炎症例における奏効率
CR
PR
ACR 効果判定基準(%)
35.3
23.5
ループス腎炎
(17 例)
LUNAR 効果判定基準(%)
29.4
23.5
ACR 効果判定基準(%)
40.0
30.0
Class III/IV の
ループス腎炎(10 例) LUNAR効果判定基準(%)
40.0
20.0
奏効率[95%信頼区間]
58.8[32.9, 81.6]
52.9[27.8, 77.0]
70.0[34.8, 93.3]
60.0[26.2, 87.8]
本剤に関連する有害事象は 154 件発現し、多くは grade 1 又は 2 であり、grade 3 又は 4 の有
害事象は 10 件であった。これらの事象は、治療により回復又は改善した。Infusion reaction は
14 件発現したが、すべて grade 1 又は 2 の事象であり、本剤の投与中止に至った事象はなかっ
た。また、本試験における死亡例も認められなかった。
34) 田中良哉, 他. SLE に対する抗 CD20 抗体療法の開発に関する研究. 厚生科学研究費補助
金(免疫・アレルギー疾患予防・治療研究事業)免疫疾患に対する免疫抑制療法等先端
的新規治療法に関する研究 平成 19 年度分担研究報告書.47)
治療抵抗性の重症 SLE を対象としたパイロットスタディが実施され、本剤の長期有効性、
長期安全性等が検討された。
BILAG カテゴリーA を 1 項目以上満たす既存治療抵抗性の SLE 患者 20 例が対象とされた。
本剤は、375 mg/m2 を 1 週間間隔で 2 回投与した。
疾患活動性スコア SLEDAI は 28 日後に改善し、20 例中 13 例で 1~17 カ月以内に寛解
(SLEDAI= 0)に至った。中枢神経 SLE を伴う 13 例は、本剤投与により全例が回復し、ルー
プス腎炎を伴う 11 例中 8 例で尿蛋白が 0.5 g/日以下まで改善した。20 例中 5 例が本剤投与か
ら 7~23 カ月後に再燃し、2 例が本剤を再投与、2 例が静脈内 CY パルス療法により改善した。
しかし、1 例では本剤再投与後に著明な HACA 産生を認めたため、パルス療法を施行した。
安全性について、帯状疱疹ヘルペスが 3 例、肺炎及び褥瘡感染症が各 1 例に認められた。
また、注射時に浮腫や倦怠感等が認められた。本試験中に 2 例が死亡した。1 例は本剤投与 7
カ月後にくも膜下出血により、もう 1 例は本剤再投与から 6 カ月後に皮質下出血により死亡
したが、いずれも本剤との因果関係は認められなかった。
小児
なし
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
成人
1) Díaz-Lagares C, et al. Efficacy of rituximab in 164 patients with biopsy-proven lupus nephritis:
pooled data from European cohorts. Autoimmun Rev 2012; 11: 357-64. 48)
腎生検によりループス腎炎と診断され本剤の治療を受けた患者を対象とした統合解析結果
に関する報告。
26
ループス腎炎症例における奏効率
CR
PR
ACR 効果判定基準(%)
35.3
23.5
ループス腎炎
(17 例)
LUNAR 効果判定基準(%)
29.4
23.5
ACR 効果判定基準(%)
40.0
30.0
Class III/IV の
ループス腎炎(10 例) LUNAR効果判定基準(%)
40.0
20.0
奏効率[95%信頼区間]
58.8[32.9, 81.6]
52.9[27.8, 77.0]
70.0[34.8, 93.3]
60.0[26.2, 87.8]
本剤に関連する有害事象は 154 件発現し、多くは grade 1 又は 2 であり、grade 3 又は 4 の有
害事象は 10 件であった。これらの事象は、治療により回復又は改善した。Infusion reaction は
14 件発現したが、すべて grade 1 又は 2 の事象であり、本剤の投与中止に至った事象はなかっ
た。また、本試験における死亡例も認められなかった。
34) 田中良哉, 他. SLE に対する抗 CD20 抗体療法の開発に関する研究. 厚生科学研究費補助
金(免疫・アレルギー疾患予防・治療研究事業)免疫疾患に対する免疫抑制療法等先端
的新規治療法に関する研究 平成 19 年度分担研究報告書.47)
治療抵抗性の重症 SLE を対象としたパイロットスタディが実施され、本剤の長期有効性、
長期安全性等が検討された。
BILAG カテゴリーA を 1 項目以上満たす既存治療抵抗性の SLE 患者 20 例が対象とされた。
本剤は、375 mg/m2 を 1 週間間隔で 2 回投与した。
疾患活動性スコア SLEDAI は 28 日後に改善し、20 例中 13 例で 1~17 カ月以内に寛解
(SLEDAI= 0)に至った。中枢神経 SLE を伴う 13 例は、本剤投与により全例が回復し、ルー
プス腎炎を伴う 11 例中 8 例で尿蛋白が 0.5 g/日以下まで改善した。20 例中 5 例が本剤投与か
ら 7~23 カ月後に再燃し、2 例が本剤を再投与、2 例が静脈内 CY パルス療法により改善した。
しかし、1 例では本剤再投与後に著明な HACA 産生を認めたため、パルス療法を施行した。
安全性について、帯状疱疹ヘルペスが 3 例、肺炎及び褥瘡感染症が各 1 例に認められた。
また、注射時に浮腫や倦怠感等が認められた。本試験中に 2 例が死亡した。1 例は本剤投与 7
カ月後にくも膜下出血により、もう 1 例は本剤再投与から 6 カ月後に皮質下出血により死亡
したが、いずれも本剤との因果関係は認められなかった。
小児
なし
(2)Peer-reviewed journal の総説、メタ・アナリシス等の報告状況
代表的な公表文献の概略について、以下に示す。
成人
1) Díaz-Lagares C, et al. Efficacy of rituximab in 164 patients with biopsy-proven lupus nephritis:
pooled data from European cohorts. Autoimmun Rev 2012; 11: 357-64. 48)
腎生検によりループス腎炎と診断され本剤の治療を受けた患者を対象とした統合解析結果
に関する報告。
26