よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
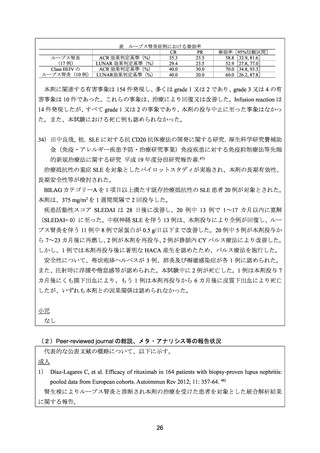
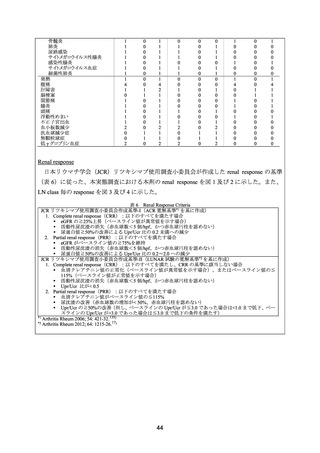
nephritis: a long-term prospective study. Nephrol Dial Transplant 2009; 24: 2157-60. 19)
16~36 歳の増殖性ループス腎炎(Class III/IV)が再燃した患者 10 例を対象とした前方視的
観察研究。本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。MMF 及びプレドニゾロンを併用し
た。
ループス腎炎に関する有効性について、CR は、尿蛋白が 0.5 g/日未満、尿沈渣正常、血清
クレアチニン及びアルブミンが正常とし、PR は、ベースライン時に異常が認められたすべて
の腎機能評価項目が 50%超改善と定義した。
10 例中奏効は 8 例(CR:7 例、PR:1 例)に認められた。38 カ月時点(中央値)において、
CR を維持していた症例は 6 例であった。
安全性について、観察期間中に重篤な感染症や日和見感染症は認められなかった。
21) Sfikakis PP, et al. Remission of proliferative lupus nephritis following B cell depletion therapy is
preceded by down-regulation of the T cell costimulatory molecule CD40 ligand: an open-label
trial. Arthritis Rheum 2005; 52: 501-13. 38)
19~38 歳の活動性の増殖性ループス腎炎患者(WHO 分類 Class III/IV)10 例が非盲検試験
に組み入れられ、本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。経口プレドニゾロンを併用
した。
有効性について、CR は、尿蛋白が 0.5 g/日未満、尿沈渣正常、血清クレアチニン及び血清
アルブミンが正常とし、PR は、ベースライン時に異常が認められたすべての腎機能評価項目
が 50%以上改善し、悪化を認めない場合と定義した。
10 例中 8 例(80%)が治療開始から 1~4 カ月(中央値 2 カ月)で PR となり、そのうち 5
例が治療開始から 2~8 カ月(中央値 3 カ月)で CR となった。CR の 5 例中 4 例は 12 カ月時
点で CR を維持していた。CR の 1 例、PR の 2 例で再燃が認められた。
安全性について、1 例で、本剤 2 回目投与後に過敏反応(発疹及び発熱)が認められ、治
療により回復したが、以降の本剤の投与を中止した。B 細胞数低下中に軽度の上気道感染又
は膀胱炎が 3 例で認められた。1 例で肺炎球菌性髄膜炎が認められたが、治療により回復し
た。
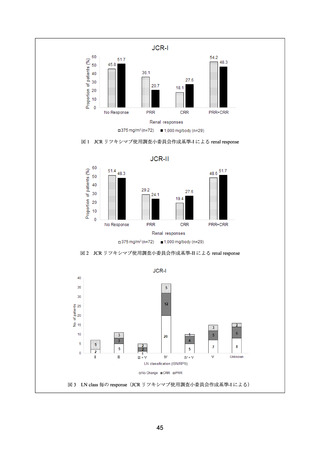
22) Gunnarsson I, et al. Histopathologic and clinical outcome of rituximab treatment in patients with
cyclophosphamide-resistant proliferative lupus nephritis. Arthritis Rheum 2007; 56: 1263-72. 39)
19~43 歳の標準治療に抵抗性を示す増殖性ループス腎炎患者(WHO 分類 Class III/IV)7
例に対して、本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。CY 及びステロイドを併用した。
有効性について、CR は、尿中アルブミンが 0.5 g/日未満、尿沈渣正常、血清クレアチニン
及び血清アルブミンが正常とし、PR は、ベースライン時に異常が認められていたすべての腎
機能評価項目が 50%以上改善し、悪化を認めない場合と定義した。
6 カ月時点において、CR は 3/7 例、PR は 1/7 例に認められた。
安全性について、有害事象は、6 カ月時点までに 7 例中 4 例に認められた(光線過敏性発
19
16~36 歳の増殖性ループス腎炎(Class III/IV)が再燃した患者 10 例を対象とした前方視的
観察研究。本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。MMF 及びプレドニゾロンを併用し
た。
ループス腎炎に関する有効性について、CR は、尿蛋白が 0.5 g/日未満、尿沈渣正常、血清
クレアチニン及びアルブミンが正常とし、PR は、ベースライン時に異常が認められたすべて
の腎機能評価項目が 50%超改善と定義した。
10 例中奏効は 8 例(CR:7 例、PR:1 例)に認められた。38 カ月時点(中央値)において、
CR を維持していた症例は 6 例であった。
安全性について、観察期間中に重篤な感染症や日和見感染症は認められなかった。
21) Sfikakis PP, et al. Remission of proliferative lupus nephritis following B cell depletion therapy is
preceded by down-regulation of the T cell costimulatory molecule CD40 ligand: an open-label
trial. Arthritis Rheum 2005; 52: 501-13. 38)
19~38 歳の活動性の増殖性ループス腎炎患者(WHO 分類 Class III/IV)10 例が非盲検試験
に組み入れられ、本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。経口プレドニゾロンを併用
した。
有効性について、CR は、尿蛋白が 0.5 g/日未満、尿沈渣正常、血清クレアチニン及び血清
アルブミンが正常とし、PR は、ベースライン時に異常が認められたすべての腎機能評価項目
が 50%以上改善し、悪化を認めない場合と定義した。
10 例中 8 例(80%)が治療開始から 1~4 カ月(中央値 2 カ月)で PR となり、そのうち 5
例が治療開始から 2~8 カ月(中央値 3 カ月)で CR となった。CR の 5 例中 4 例は 12 カ月時
点で CR を維持していた。CR の 1 例、PR の 2 例で再燃が認められた。
安全性について、1 例で、本剤 2 回目投与後に過敏反応(発疹及び発熱)が認められ、治
療により回復したが、以降の本剤の投与を中止した。B 細胞数低下中に軽度の上気道感染又
は膀胱炎が 3 例で認められた。1 例で肺炎球菌性髄膜炎が認められたが、治療により回復し
た。
22) Gunnarsson I, et al. Histopathologic and clinical outcome of rituximab treatment in patients with
cyclophosphamide-resistant proliferative lupus nephritis. Arthritis Rheum 2007; 56: 1263-72. 39)
19~43 歳の標準治療に抵抗性を示す増殖性ループス腎炎患者(WHO 分類 Class III/IV)7
例に対して、本剤 375 mg/m2 を 1 週間間隔で 4 回投与した。CY 及びステロイドを併用した。
有効性について、CR は、尿中アルブミンが 0.5 g/日未満、尿沈渣正常、血清クレアチニン
及び血清アルブミンが正常とし、PR は、ベースライン時に異常が認められていたすべての腎
機能評価項目が 50%以上改善し、悪化を認めない場合と定義した。
6 カ月時点において、CR は 3/7 例、PR は 1/7 例に認められた。
安全性について、有害事象は、6 カ月時点までに 7 例中 4 例に認められた(光線過敏性発
19