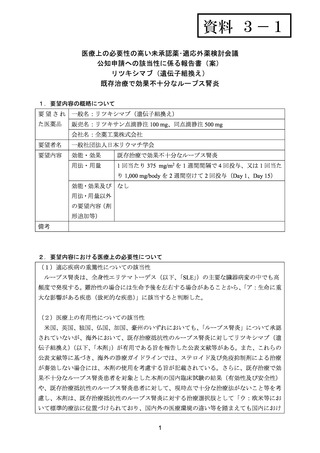
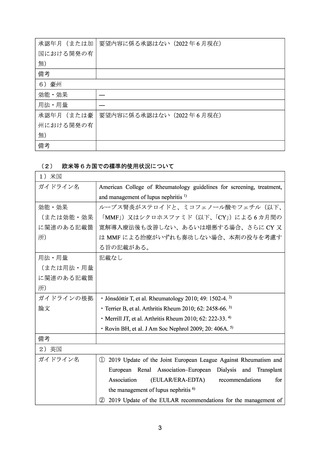
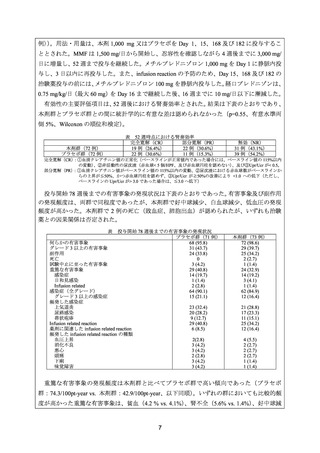
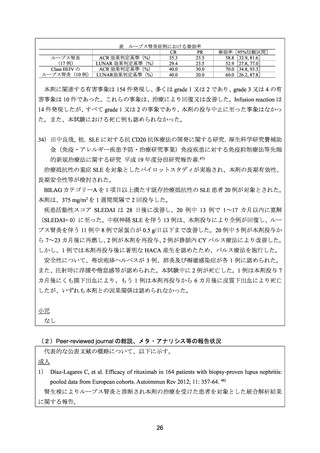
よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
例)及び 46.7%(7/15 例)であった。36 カ月時点の無再発率は本剤、MMF 及び CY 投与例で
それぞれ 100%(17/17 例)、83%(10/12 例)及び 53%(8/15 例)であった。
安全性について、有害事象の発現割合は、本剤、MMF 及び CY 投与例でそれぞれ 29.4%(5/17
例)、58.3%(7/12 例)及び 100%(15/15 例)であった。重篤な有害事象は、CY 投与例の 4
例に認められた。死亡は CY 投与例の 1 例に認められた。本剤群の 4 例では、本剤投与直後
に蕁麻疹を認めたが、それ以外の事象は認められなかった。また、1 例で水痘帯状疱疹感染
症を認めたが、入院の必要はなかった。
27) Watson L, et al. The indications, efficacy and adverse events of rituximab in a large cohort of
patients with juvenile-onset SLE. Lupus 2015; 24: 10-7. 24)
若年性 SLE 患者における本剤の臨床的適応、
有効性及び安全性について明らかにするため、
コホート研究が実施された。
17 歳以前に ACR の分類基準に基づいて若年性 SLE と臨床診断され、本剤の投与を受けた
患者を、地域の処方記録と英国若年性 SLE コホート研究データベースを用いて特定した。
若年性 SLE 患者 63 例が登録され、本剤投与時の年齢は 14.4 歳(四分位範囲:12.0~15.5
歳)であり、若年性 SLE の診断後 1.4 年(四分位範囲:0.2~3.0 年)であった。若年性 SLE
診断から本剤投与までの期間が短い症例は腎機能障害を有している傾向があった。全例で本
剤 750 mg/m2 が約 14 日間隔で 2 回投与され、多くの症例で CY(375 mg/m2)の前投与が行わ
れていた。本剤は 63 例で合計 104 コース(約 14 日間隔での 2 回投与を 1 コースとする)投
与されていた。19 例は 2 コース以上本剤を投与しており、19 例の平均投与コース数は 3.2 コ
ース(範囲:2~6 コース)であった。本剤を使用した適応について、難治性のループス腎炎
が最も多かった(初回コースの 36%)
。
本剤による治療後 2.5 カ月(四分位範囲:1.6~4.3 カ月)における臨床バイオマーカーの評
価(63 例)では、赤血球沈降速度、C3、C4、クレアチニン、アルブミン、ヘモグロビン、抗
dsDNA 抗体価及び尿アルブミン/クレアチニン比が改善し、IgG、IgA 及び IgM レベルが減
少した。また、本剤投与後、経口副腎皮質ステロイドの投与量が減少した。
安全性について、本剤投与全 104 コースのうち 19 コースで有害事象が認められた(18%)。
本剤 2 回目の投与の延期が必要となった有害事象が全コースの 8%で認められた。投与延期の
理由は、発熱(3 コース)、好中球減少、食道狭窄手術、薬剤未入手、病院のベッド不足、上
気道感染(各 1 コース)であった。また、免疫グロブリン補充療法が必要となった症例が全
コースの 2%に認められた。アレルギー反応は全コースの 6%に認められ、そのうちの 4%は
軽度又は中等度であり、2%はアナフィラキシーであった。また、2%の症例では治療後 3 カ月
以内に感染症が認められた(1 例はサイトメガロウイルス及びアデノウイルス、1 例が帯状疱
疹)。
28) Trachana M, et al. Safety and efficacy of rituximab in refractory pediatric systemic lupus
erythematosus nephritis: a single-center experience of Northern Greece. Rheumatol Int 2013; 33:
22
それぞれ 100%(17/17 例)、83%(10/12 例)及び 53%(8/15 例)であった。
安全性について、有害事象の発現割合は、本剤、MMF 及び CY 投与例でそれぞれ 29.4%(5/17
例)、58.3%(7/12 例)及び 100%(15/15 例)であった。重篤な有害事象は、CY 投与例の 4
例に認められた。死亡は CY 投与例の 1 例に認められた。本剤群の 4 例では、本剤投与直後
に蕁麻疹を認めたが、それ以外の事象は認められなかった。また、1 例で水痘帯状疱疹感染
症を認めたが、入院の必要はなかった。
27) Watson L, et al. The indications, efficacy and adverse events of rituximab in a large cohort of
patients with juvenile-onset SLE. Lupus 2015; 24: 10-7. 24)
若年性 SLE 患者における本剤の臨床的適応、
有効性及び安全性について明らかにするため、
コホート研究が実施された。
17 歳以前に ACR の分類基準に基づいて若年性 SLE と臨床診断され、本剤の投与を受けた
患者を、地域の処方記録と英国若年性 SLE コホート研究データベースを用いて特定した。
若年性 SLE 患者 63 例が登録され、本剤投与時の年齢は 14.4 歳(四分位範囲:12.0~15.5
歳)であり、若年性 SLE の診断後 1.4 年(四分位範囲:0.2~3.0 年)であった。若年性 SLE
診断から本剤投与までの期間が短い症例は腎機能障害を有している傾向があった。全例で本
剤 750 mg/m2 が約 14 日間隔で 2 回投与され、多くの症例で CY(375 mg/m2)の前投与が行わ
れていた。本剤は 63 例で合計 104 コース(約 14 日間隔での 2 回投与を 1 コースとする)投
与されていた。19 例は 2 コース以上本剤を投与しており、19 例の平均投与コース数は 3.2 コ
ース(範囲:2~6 コース)であった。本剤を使用した適応について、難治性のループス腎炎
が最も多かった(初回コースの 36%)
。
本剤による治療後 2.5 カ月(四分位範囲:1.6~4.3 カ月)における臨床バイオマーカーの評
価(63 例)では、赤血球沈降速度、C3、C4、クレアチニン、アルブミン、ヘモグロビン、抗
dsDNA 抗体価及び尿アルブミン/クレアチニン比が改善し、IgG、IgA 及び IgM レベルが減
少した。また、本剤投与後、経口副腎皮質ステロイドの投与量が減少した。
安全性について、本剤投与全 104 コースのうち 19 コースで有害事象が認められた(18%)。
本剤 2 回目の投与の延期が必要となった有害事象が全コースの 8%で認められた。投与延期の
理由は、発熱(3 コース)、好中球減少、食道狭窄手術、薬剤未入手、病院のベッド不足、上
気道感染(各 1 コース)であった。また、免疫グロブリン補充療法が必要となった症例が全
コースの 2%に認められた。アレルギー反応は全コースの 6%に認められ、そのうちの 4%は
軽度又は中等度であり、2%はアナフィラキシーであった。また、2%の症例では治療後 3 カ月
以内に感染症が認められた(1 例はサイトメガロウイルス及びアデノウイルス、1 例が帯状疱
疹)。
28) Trachana M, et al. Safety and efficacy of rituximab in refractory pediatric systemic lupus
erythematosus nephritis: a single-center experience of Northern Greece. Rheumatol Int 2013; 33:
22