よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5) Murray E, et al. Off-label use of rituximab in systemic lupus erythematosus: a systemic review.
Clin Rheumatol 2010; 29: 707-16. 50)
MEDLINE、Embase、Cinahl、Cochrane library 及び引用文献に対して、“rituximab”及び“systemic
lupus erythematosus” をキーワードとして検索し、公表前の報告を企業に確認した。最終的に
29 報を選択した。
本剤の用法・用量は試験間で様々であり、主に 375 mg/m2 を 1 週間間隔で 4 回投与又は
1,000 mg を 2 週間間隔で 2 回投与されていた。いずれの用法・用量でも疾患の再燃に先立っ
て B 細胞数の回復が認められた。
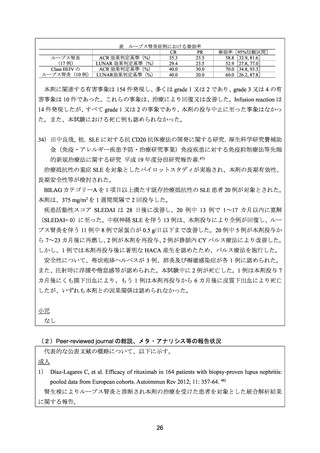
ループス腎炎を対象とした小規模なオープン試験の報告 8 件(計 96 例)を対象とした解析
では、CR が 26 例(27%)、PR が 37 例(39%)であった。なお、CR は、血清クレアチニン
及び血清アルブミンが正常値となり、尿沈渣正常、尿蛋白が 0.5 g/日未満となった場合とし、
PR は、異常を認めた腎機能評価項目が 50%を超えて改善した場合と定義した。
安全性について、報告されたほとんどの有害事象は、軽度な infusion reaction であった。し
かしながら、まれに血清病様反応、腫瘍崩壊症候群や進行性多巣性白質脳症を含む重篤な副
作用が報告されている。
6) Duxbury B, et al. Rituximab in systemic lupus erythematosus: an updated systematic review
and meta-analysis. Lupus 2013; 22: 1489-1503. 51)
MEDLINE 及び Embase において、2002 年 1 月 1 日から 2012 年 10 月 31 日までに公表され
た報告を対象に、“rituximab”、及び“systemic lupus erythematosus”のキーワードで検索した。無
作為化試験又は 10 例以上の成人患者を含む症例報告を選択し、総説、成人 10 例未満又は小
児の症例報告、主要な結果が臨床ではない文献及び学会抄録を除く 30 試験 1,243 例を対象に
解析した。そのうち、ループス腎炎を対象とした非盲検試験は 11 試験 201 例であった。
201 例の多くは、治療にもかかわらず活動性の増殖性ループス腎炎であった。WHO 分類又
は ISN/RPS 基準に基づく分類は、Class III:22 例、Class IV:76 例、Class III/IV:26 例、Class
III/V:12 例、Class IV/V:6 例、Class V:12 例、Class II:3 例であった。4 つの試験では、ル
ープス腎炎に対する初期治療として本剤が使用されていた(SLE に対する前治療はあり)。
本剤の用法・用量は、1,000 mg を 2 回投与(89 例)
、375 mg/m2 を 4 回投与(61 例)又はそ
の他であった。
CR 及び PR を評価項目とした 10 試験を統合した結果、CR の割合は 36.1%、PR の割合は
37.4%であった。11 試験の総合評価を統合した奏効率は 72.1%であった。
7) Alshaiki, et al. Outcomes of rituximab therapy in refractory lupus: A meta-analysis. Eur J
Rheumatol 2018; 5: 118-26. 9)
PubMed 及び EMBASE において、
“Rituximab”
、
“Lupus erythematosus”等のキーワードで検
索された 1,801 件から、重複や抄録、症例報告等を除く 10 例以上を対象とした臨床研究の英
語論文を抽出し、これらの論文を 2 名の独立した研究者が精査し、31 報についてメタ・アナ
30
Clin Rheumatol 2010; 29: 707-16. 50)
MEDLINE、Embase、Cinahl、Cochrane library 及び引用文献に対して、“rituximab”及び“systemic
lupus erythematosus” をキーワードとして検索し、公表前の報告を企業に確認した。最終的に
29 報を選択した。
本剤の用法・用量は試験間で様々であり、主に 375 mg/m2 を 1 週間間隔で 4 回投与又は
1,000 mg を 2 週間間隔で 2 回投与されていた。いずれの用法・用量でも疾患の再燃に先立っ
て B 細胞数の回復が認められた。
ループス腎炎を対象とした小規模なオープン試験の報告 8 件(計 96 例)を対象とした解析
では、CR が 26 例(27%)、PR が 37 例(39%)であった。なお、CR は、血清クレアチニン
及び血清アルブミンが正常値となり、尿沈渣正常、尿蛋白が 0.5 g/日未満となった場合とし、
PR は、異常を認めた腎機能評価項目が 50%を超えて改善した場合と定義した。
安全性について、報告されたほとんどの有害事象は、軽度な infusion reaction であった。し
かしながら、まれに血清病様反応、腫瘍崩壊症候群や進行性多巣性白質脳症を含む重篤な副
作用が報告されている。
6) Duxbury B, et al. Rituximab in systemic lupus erythematosus: an updated systematic review
and meta-analysis. Lupus 2013; 22: 1489-1503. 51)
MEDLINE 及び Embase において、2002 年 1 月 1 日から 2012 年 10 月 31 日までに公表され
た報告を対象に、“rituximab”、及び“systemic lupus erythematosus”のキーワードで検索した。無
作為化試験又は 10 例以上の成人患者を含む症例報告を選択し、総説、成人 10 例未満又は小
児の症例報告、主要な結果が臨床ではない文献及び学会抄録を除く 30 試験 1,243 例を対象に
解析した。そのうち、ループス腎炎を対象とした非盲検試験は 11 試験 201 例であった。
201 例の多くは、治療にもかかわらず活動性の増殖性ループス腎炎であった。WHO 分類又
は ISN/RPS 基準に基づく分類は、Class III:22 例、Class IV:76 例、Class III/IV:26 例、Class
III/V:12 例、Class IV/V:6 例、Class V:12 例、Class II:3 例であった。4 つの試験では、ル
ープス腎炎に対する初期治療として本剤が使用されていた(SLE に対する前治療はあり)。
本剤の用法・用量は、1,000 mg を 2 回投与(89 例)
、375 mg/m2 を 4 回投与(61 例)又はそ
の他であった。
CR 及び PR を評価項目とした 10 試験を統合した結果、CR の割合は 36.1%、PR の割合は
37.4%であった。11 試験の総合評価を統合した奏効率は 72.1%であった。
7) Alshaiki, et al. Outcomes of rituximab therapy in refractory lupus: A meta-analysis. Eur J
Rheumatol 2018; 5: 118-26. 9)
PubMed 及び EMBASE において、
“Rituximab”
、
“Lupus erythematosus”等のキーワードで検
索された 1,801 件から、重複や抄録、症例報告等を除く 10 例以上を対象とした臨床研究の英
語論文を抽出し、これらの論文を 2 名の独立した研究者が精査し、31 報についてメタ・アナ
30