よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
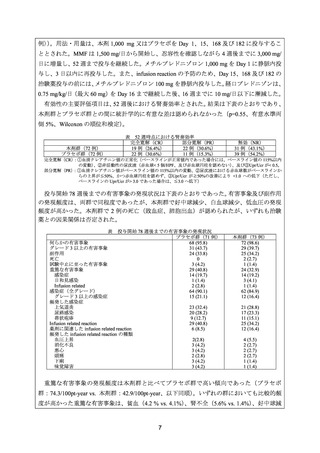
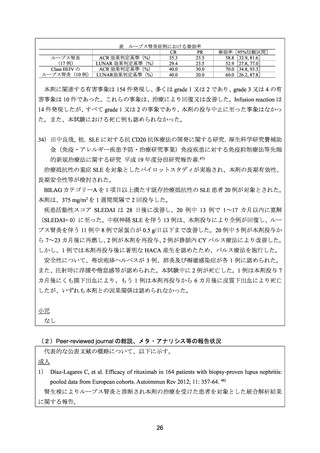
809-13. 20)
11~18 歳の重症かつ難治性のループス腎炎患者 4 例に対して、本剤 375~500 mg/m2 を 14
~20 日間隔で 4 回投与した。
有効性について、CR は、アルブミン値、尿蛋白(500 mg/日未満)、血清シスタチン C 値等、
腎機能障害に起因するすべての臨床検査値異常が正常化した場合とし、PR は、血清シスタチ
ン C 値の安定化又は正常化を伴う尿蛋白の 50%以上の改善と定義した。
4 例全例が本剤開始後 2~4 カ月で CR を達成し、3 例はフォローアップ期間中も CR を維持
した。1 例は本剤投与開始 15 カ月後に再燃したが、本剤を 1 回追加投与し、PR(尿蛋白が 50%
減少)となった。
安全性について、重篤な輸注関連有害事象や重篤な感染症は認められなかった。
29) Willems M, et al. Rituximab therapy for childhood-onset systemic lupus erythematosus. J Pediatr
2006; 148: 623-7. 43)
8.3~19.0 歳の難治性 SLE 患者 11 例(ループス腎炎患者 8 例〈Class IV:6 例、Class V:2
例〉を含む)を対象とした後方視的研究。本剤 350~450 mg/m2 を 2~12 回投与した。全例で
0.2~1.5 mg/kg/日のプレドニゾンを併用した。2 例では維持療法(本剤 375 mg/m2 を 3~5 カ月
毎に単独投与又はアザチオプリン及びメトトレキサートと併用投与)を実施した。
有効性について、CR は、腎機能障害に係る異常値(アルブミン値、尿蛋白及び/又はクレ
アチニン値)が正常化とし、PR は、腎機能障害に係る異常値の 1 つ以上が正常化と定義した。
ループス腎炎を有する 8 例のうち、CR は 2 例、PR は 4 例に認められた。CY パルス治療で
PR に至らなかった症例においても CR が認められた。奏効(CR 又は PR)は、本剤初回投与
後 2~9 カ月に認められた。奏効例の平均追跡期間は 13.2 カ月(範囲:6~26 カ月)であり、
再燃後に本剤 2 コース目の投与で再治療が成功した 1 例を除き、全例で CR 又は PR が持続し
た。2 例では症状の改善が認められなかった。本剤 2 回目投与後に重症の副作用により本剤
の投与を中止せざるを得なかった 1 例では、本剤初回投与から 4 カ月後においても改善は認
められなかった。
安全性について、重症の副作用は 11 例中 5 例に認められ、敗血症は 2 例(1 例では本剤投
与 2 カ月以内に発現)であった。重症の血液毒性は 4 例に認められ、2 例では本剤投与の 1
~3 日後に発現し、5~10 日以内に回復した。中等症の副作用は 5 例に認められ、重症でない
感染症は 3 例に認められた。IgG 値及び IgM 値の低下がそれぞれ 3 例及び 5 例に認められ、4
例では月 1 回の IVIG 投与を実施した。
30) Nwobi O, et al. Rituximab therapy for juvenile-onset systemic lupus erythematosus. Pediatr
Nephrol 2008; 23: 413-9. 44)
14.2±3.3 歳(平均値±標準偏差)の難治性 SLE 患者 18 例(全例がループス腎炎を合併)
を対象とした後方視的研究。本剤は、初回の投与量を 188 mg/m2 、2 回目以降の投与量を
375 mg/m2 とし、1 週間間隔で合計 2~4 回投与した。
23
11~18 歳の重症かつ難治性のループス腎炎患者 4 例に対して、本剤 375~500 mg/m2 を 14
~20 日間隔で 4 回投与した。
有効性について、CR は、アルブミン値、尿蛋白(500 mg/日未満)、血清シスタチン C 値等、
腎機能障害に起因するすべての臨床検査値異常が正常化した場合とし、PR は、血清シスタチ
ン C 値の安定化又は正常化を伴う尿蛋白の 50%以上の改善と定義した。
4 例全例が本剤開始後 2~4 カ月で CR を達成し、3 例はフォローアップ期間中も CR を維持
した。1 例は本剤投与開始 15 カ月後に再燃したが、本剤を 1 回追加投与し、PR(尿蛋白が 50%
減少)となった。
安全性について、重篤な輸注関連有害事象や重篤な感染症は認められなかった。
29) Willems M, et al. Rituximab therapy for childhood-onset systemic lupus erythematosus. J Pediatr
2006; 148: 623-7. 43)
8.3~19.0 歳の難治性 SLE 患者 11 例(ループス腎炎患者 8 例〈Class IV:6 例、Class V:2
例〉を含む)を対象とした後方視的研究。本剤 350~450 mg/m2 を 2~12 回投与した。全例で
0.2~1.5 mg/kg/日のプレドニゾンを併用した。2 例では維持療法(本剤 375 mg/m2 を 3~5 カ月
毎に単独投与又はアザチオプリン及びメトトレキサートと併用投与)を実施した。
有効性について、CR は、腎機能障害に係る異常値(アルブミン値、尿蛋白及び/又はクレ
アチニン値)が正常化とし、PR は、腎機能障害に係る異常値の 1 つ以上が正常化と定義した。
ループス腎炎を有する 8 例のうち、CR は 2 例、PR は 4 例に認められた。CY パルス治療で
PR に至らなかった症例においても CR が認められた。奏効(CR 又は PR)は、本剤初回投与
後 2~9 カ月に認められた。奏効例の平均追跡期間は 13.2 カ月(範囲:6~26 カ月)であり、
再燃後に本剤 2 コース目の投与で再治療が成功した 1 例を除き、全例で CR 又は PR が持続し
た。2 例では症状の改善が認められなかった。本剤 2 回目投与後に重症の副作用により本剤
の投与を中止せざるを得なかった 1 例では、本剤初回投与から 4 カ月後においても改善は認
められなかった。
安全性について、重症の副作用は 11 例中 5 例に認められ、敗血症は 2 例(1 例では本剤投
与 2 カ月以内に発現)であった。重症の血液毒性は 4 例に認められ、2 例では本剤投与の 1
~3 日後に発現し、5~10 日以内に回復した。中等症の副作用は 5 例に認められ、重症でない
感染症は 3 例に認められた。IgG 値及び IgM 値の低下がそれぞれ 3 例及び 5 例に認められ、4
例では月 1 回の IVIG 投与を実施した。
30) Nwobi O, et al. Rituximab therapy for juvenile-onset systemic lupus erythematosus. Pediatr
Nephrol 2008; 23: 413-9. 44)
14.2±3.3 歳(平均値±標準偏差)の難治性 SLE 患者 18 例(全例がループス腎炎を合併)
を対象とした後方視的研究。本剤は、初回の投与量を 188 mg/m2 、2 回目以降の投与量を
375 mg/m2 とし、1 週間間隔で合計 2~4 回投与した。
23