よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (47 ページ)
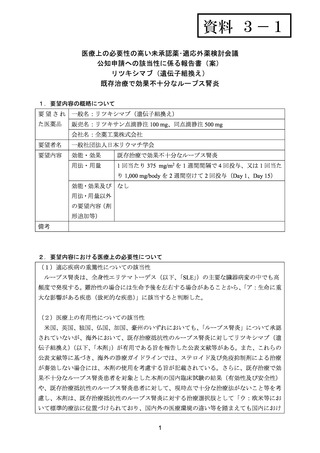
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
験が確認されている。
以上より、医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、
既存治療で効果不十分な成人及び小児のループス腎炎に対する本剤の有効性は期待できると
考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
国内外の公表論文等において、既存治療で効果不十分なループス腎炎に対して本剤を投与
した際に認められた主な有害事象は、infusion reaction、感染症、血球減少等、本剤の既承認
の効能・効果において既知の事象であり、現行の添付文書で注意喚起がなされている。
また、本剤は本邦で 2001 年に承認されて以降、CD20 陽性の B 細胞性非ホジキンリンパ腫、
難治性ネフローゼ症候群等に係る複数の効能・効果で承認されており、小児を含む日本人に
おける安全性情報が蓄積されている。
以上より、検討会議は、緊急時に十分に対応できる医療施設において、ループス腎炎に十
分な経験・知識を持つ医師のもとで、現行の添付文書に準じて使用されるのであれば、既存
治療で効果不十分な成人及び小児のループス腎炎に対する本剤の安全性は許容可能と考え
る。
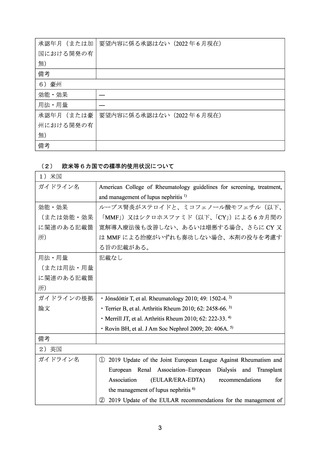
(3)要望内容に係る公知申請の妥当性について
国内外の診療ガイドライン、教科書、公表文献等から、既存治療で効果不十分な成人及び
小児のループス腎炎に対する本剤の有効性が認められている(「7.(1)要望内容に係る外
国人におけるエビデンス及び日本人における有効性の総合評価について」の項参照)。
安全性について、国内外の公表文献等で認められた主な有害事象は、本剤の既承認の効能・
効果において既知の事象であり、本剤の現行の添付文書に準じて使用される限り、安全性は
許容可能と考える(「7.(2)要望内容に係る外国人におけるエビデンス及び日本人における
安全性の総合評価について」の項参照)。
以上より、検討会議は、既存治療で効果不十分な成人及び小児のループス腎炎に対する本
剤の有用性は、医学薬学上公知であると判断する。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、以下の設定とすることが適当と検討会議は考える。その妥当性に
ついて以下に記す。
【効能・効果】(要望内容に関連する部分のみ抜粋)
○既存治療で効果不十分なループス腎炎
47
以上より、医療上の必要性の高い未承認薬・適応外薬検討会議(以下、
「検討会議」
)は、
既存治療で効果不十分な成人及び小児のループス腎炎に対する本剤の有効性は期待できると
考える。
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
国内外の公表論文等において、既存治療で効果不十分なループス腎炎に対して本剤を投与
した際に認められた主な有害事象は、infusion reaction、感染症、血球減少等、本剤の既承認
の効能・効果において既知の事象であり、現行の添付文書で注意喚起がなされている。
また、本剤は本邦で 2001 年に承認されて以降、CD20 陽性の B 細胞性非ホジキンリンパ腫、
難治性ネフローゼ症候群等に係る複数の効能・効果で承認されており、小児を含む日本人に
おける安全性情報が蓄積されている。
以上より、検討会議は、緊急時に十分に対応できる医療施設において、ループス腎炎に十
分な経験・知識を持つ医師のもとで、現行の添付文書に準じて使用されるのであれば、既存
治療で効果不十分な成人及び小児のループス腎炎に対する本剤の安全性は許容可能と考え
る。
(3)要望内容に係る公知申請の妥当性について
国内外の診療ガイドライン、教科書、公表文献等から、既存治療で効果不十分な成人及び
小児のループス腎炎に対する本剤の有効性が認められている(「7.(1)要望内容に係る外
国人におけるエビデンス及び日本人における有効性の総合評価について」の項参照)。
安全性について、国内外の公表文献等で認められた主な有害事象は、本剤の既承認の効能・
効果において既知の事象であり、本剤の現行の添付文書に準じて使用される限り、安全性は
許容可能と考える(「7.(2)要望内容に係る外国人におけるエビデンス及び日本人における
安全性の総合評価について」の項参照)。
以上より、検討会議は、既存治療で効果不十分な成人及び小児のループス腎炎に対する本
剤の有用性は、医学薬学上公知であると判断する。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、以下の設定とすることが適当と検討会議は考える。その妥当性に
ついて以下に記す。
【効能・効果】(要望内容に関連する部分のみ抜粋)
○既存治療で効果不十分なループス腎炎
47