よむ、つかう、まなぶ。
資料3-1 リツキシマブ(遺伝子組換え) (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
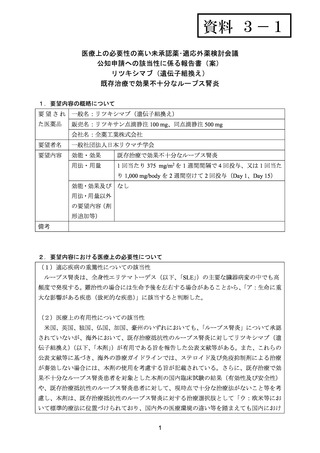
標準治療に抵抗性を示す日本人 SLE 患者を対象とした本剤の多施設共同非盲検第 II 相試験
が国内 7 施設で実施された(UMIN000000763)
。ACR 及び EULAR/ERA-EDTA による診療ガ
イドラインにおいて、既存治療抵抗性のループス腎炎に対する治療選択肢として本剤が推奨
されていることから、日本人患者に対しても適応できるかを検討するため、本試験に登録さ
れた症例のうち、ループス腎炎を合併している症例を対象とした post-hoc 解析を実施した。
ACR 基準(1997 年改訂版)を満たす抗核抗体陽性の 16~75 歳の SLE 患者で、2 週間以上
のステロイド治療(プレドニゾロン換算 0.75 mg/kg/日超)を継続したが、十分な治療効果が
得られなかった被験者が本試験の対象とされた。本試験登録前より開始したステロイド及び
免疫抑制剤は、継続して投与した。また、スクリーニング時に高疾患活動性を示した場合、
本剤投与開始前 7 日以前よりステロイドの増量を可能とした。
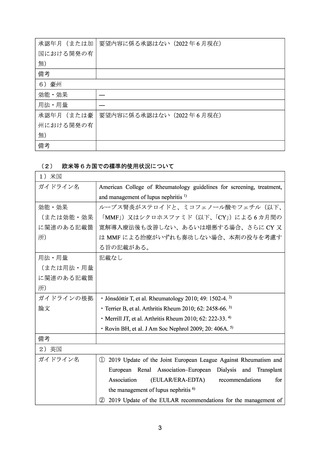
用法・用量は、本剤 1,000 mg を 2 週間間隔で 2 回(day 1 及び day 15)投与し、最初の投与
から 6 カ月後(day 169, day 183)に再度投与した。臨床的な改善が認められた時点から、ス
テロイドの漸減を開始し、2~4 週間毎に約 20%ずつ減量した。
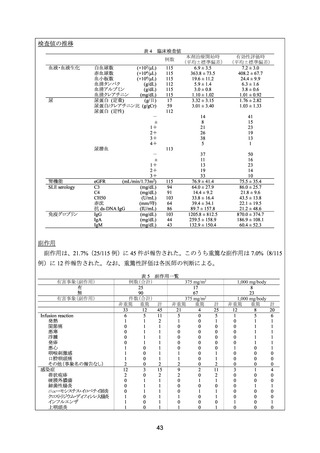
ループス腎炎に対する効果は、LUNAR 試験及び ACR ガイドラインの基準に準じて判定し
た。LUNAR 試験における CR は、血清クレアチニンがベースラインで異常を認めた場合は正
常化、ベースラインで正常範囲であった場合はベースライン時の 115%以下、尿沈渣正常(赤
血球数/hpf が 5 未満かつ赤血球円柱を認めない)
、Upr/Ucr が 0.5 未満とし、PR は、血清クレ
アチニンがベースライン時の 115%以下、尿沈渣は赤血球円柱を認めず赤血球の上昇がベース
ライン時から 50%未満、Upr/Ucr は、ベースラインが 3.0 未満の場合は Upr/Ucr が 1.0 未満で
50%以上の低下、ベースラインが 3.0 を超える場合 3.0 以下への低下とした。ACR ガイドライ
ンにおける CR は、eGFR がベースラインで異常であった場合 25%以上の上昇、尿沈渣正常(赤
血球数/hpf が 5 未満かつ赤血球円柱を認めない)
、Upr/Ucr が 50%以上低下し 0.2 に低下した
場合とし、PR は GFR が安定(ベースラインの 75%以上)、尿沈渣正常、Upr/Ucr が 50%以上
低下し 0.2~2.0 に低下した場合とした。
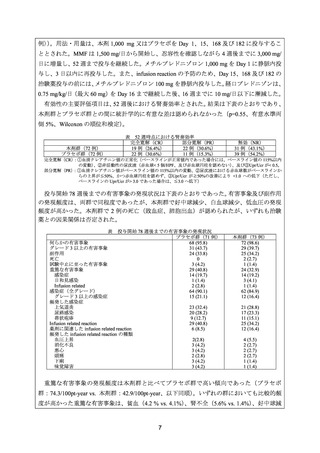
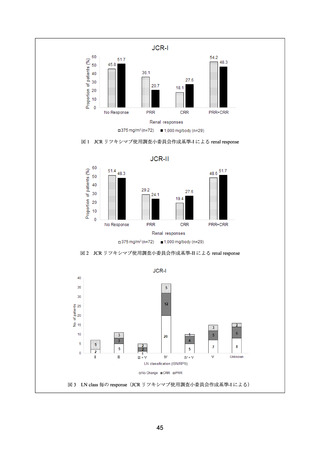
本試験に登録された 34 例のうち、スクリーニング時の Upr/Ucr が 1.0 以上であった 17 例
(ISN/RPS 基準 Class III/IV:10 例、Class IIb:1 例、Class VI:1 例、腎生検未施行:5 例)を
post-hoc 解析の対象とした。
試験中止に至った症例は 17 例中 2 例であった。1 例は、スクリーニング時に大量の尿蛋白
(Upr/Uc が 10.0)及び赤血球数/hpf が 50 個を超える血尿を伴う活動性の高いループス腎炎
(Class IV)と診断された症例で、7 カ月間にわたるステロイドパルス療法、血漿交換及び血
液透析による前治療歴を有していた。本剤 4 回投与終了後も活動性の高いループス腎炎が確
認されたことから、他治療移行のため試験中止となった。もう 1 例は、新規に Class III のル
ープス腎炎と診断された症例で、登録時の血清中の自己抗体量が高値であったことから、本
剤 2 回投与後に血漿交換を行うため、試験中止となった。
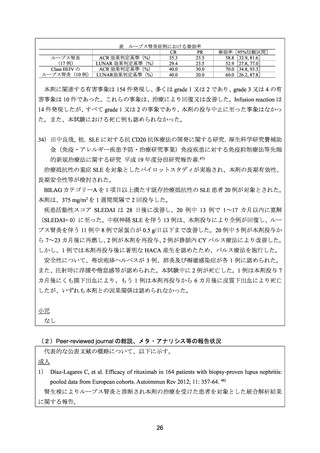
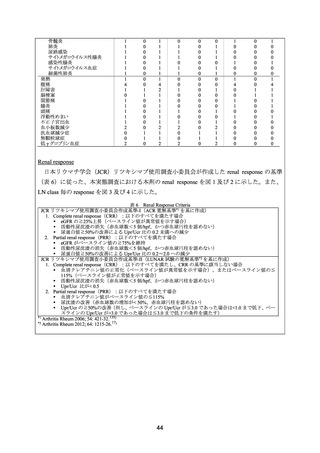
LUNAR 試験及び ACR ガイドラインの判定基準に基づく奏効率は、
下表のとおりであった。
25
が国内 7 施設で実施された(UMIN000000763)
。ACR 及び EULAR/ERA-EDTA による診療ガ
イドラインにおいて、既存治療抵抗性のループス腎炎に対する治療選択肢として本剤が推奨
されていることから、日本人患者に対しても適応できるかを検討するため、本試験に登録さ
れた症例のうち、ループス腎炎を合併している症例を対象とした post-hoc 解析を実施した。
ACR 基準(1997 年改訂版)を満たす抗核抗体陽性の 16~75 歳の SLE 患者で、2 週間以上
のステロイド治療(プレドニゾロン換算 0.75 mg/kg/日超)を継続したが、十分な治療効果が
得られなかった被験者が本試験の対象とされた。本試験登録前より開始したステロイド及び
免疫抑制剤は、継続して投与した。また、スクリーニング時に高疾患活動性を示した場合、
本剤投与開始前 7 日以前よりステロイドの増量を可能とした。
用法・用量は、本剤 1,000 mg を 2 週間間隔で 2 回(day 1 及び day 15)投与し、最初の投与
から 6 カ月後(day 169, day 183)に再度投与した。臨床的な改善が認められた時点から、ス
テロイドの漸減を開始し、2~4 週間毎に約 20%ずつ減量した。
ループス腎炎に対する効果は、LUNAR 試験及び ACR ガイドラインの基準に準じて判定し
た。LUNAR 試験における CR は、血清クレアチニンがベースラインで異常を認めた場合は正
常化、ベースラインで正常範囲であった場合はベースライン時の 115%以下、尿沈渣正常(赤
血球数/hpf が 5 未満かつ赤血球円柱を認めない)
、Upr/Ucr が 0.5 未満とし、PR は、血清クレ
アチニンがベースライン時の 115%以下、尿沈渣は赤血球円柱を認めず赤血球の上昇がベース
ライン時から 50%未満、Upr/Ucr は、ベースラインが 3.0 未満の場合は Upr/Ucr が 1.0 未満で
50%以上の低下、ベースラインが 3.0 を超える場合 3.0 以下への低下とした。ACR ガイドライ
ンにおける CR は、eGFR がベースラインで異常であった場合 25%以上の上昇、尿沈渣正常(赤
血球数/hpf が 5 未満かつ赤血球円柱を認めない)
、Upr/Ucr が 50%以上低下し 0.2 に低下した
場合とし、PR は GFR が安定(ベースラインの 75%以上)、尿沈渣正常、Upr/Ucr が 50%以上
低下し 0.2~2.0 に低下した場合とした。
本試験に登録された 34 例のうち、スクリーニング時の Upr/Ucr が 1.0 以上であった 17 例
(ISN/RPS 基準 Class III/IV:10 例、Class IIb:1 例、Class VI:1 例、腎生検未施行:5 例)を
post-hoc 解析の対象とした。
試験中止に至った症例は 17 例中 2 例であった。1 例は、スクリーニング時に大量の尿蛋白
(Upr/Uc が 10.0)及び赤血球数/hpf が 50 個を超える血尿を伴う活動性の高いループス腎炎
(Class IV)と診断された症例で、7 カ月間にわたるステロイドパルス療法、血漿交換及び血
液透析による前治療歴を有していた。本剤 4 回投与終了後も活動性の高いループス腎炎が確
認されたことから、他治療移行のため試験中止となった。もう 1 例は、新規に Class III のル
ープス腎炎と診断された症例で、登録時の血清中の自己抗体量が高値であったことから、本
剤 2 回投与後に血漿交換を行うため、試験中止となった。
LUNAR 試験及び ACR ガイドラインの判定基準に基づく奏効率は、
下表のとおりであった。
25