よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
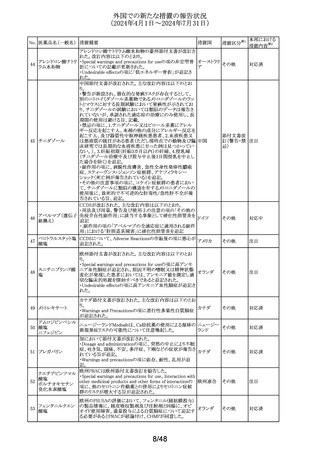
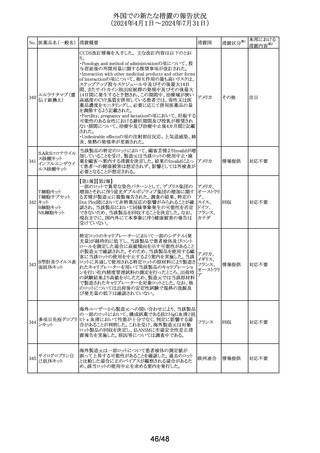
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
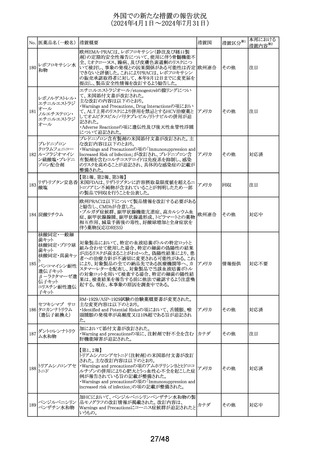
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
アルゼンチン当局より添付文書改訂の指示があった。
アルゼンチ
・Advertencias及びReacciones adversasの項に、亜硫酸塩
その他
ン
に対するアレルギー反応、過敏症反応が追記。
フロセミド
【第1報、第2報、第3報】
リシノプリル水和物 欧州EMAは、ヒト用医薬品中のニトロソアミン不純物に係る
101 デキストロメトルファ 意見書に関する販売承認取得者/申請者向けQ&Aを更新 欧州連合 その他
ン臭化水素酸塩水 し、各物質固有の一日許容摂取量とCPCA categoryを更新
和物
した。
南アフリカSAHPRA は、遺伝毒性のある医薬品の潜在的な
ドキソルビシン塩酸
胎児毒性、催奇形性について、南アフリカ添付文書を改訂 南アフリカ その他
102
塩
するよう求めた。
【第1報、第2報】
アモキシシリン水和 米国添付文書が改訂され、Warnings and Precautionsの項
アメリカ
その他
103
物
に、Drugs-Induced Enteroclitis Syndrome(DIES)が追記され
た。
100 エダラボン
104
105
タゾバクタム・ピペラシリンの米国添付文書が改訂され、
ピペラシリンナトリウ Adverse Reactionsの項に、「心筋梗塞を伴う、あるいは伴わ アメリカ、
ム
ない急性心筋虚血がアレルギー反応の一部として起こるこ 日本
とがある」及び「線状IgA水疱症」が追記された。
エスモロール塩酸
塩
乾燥スルホ化人免
疫グロブリン
106
乾燥ペプシン処理
人免疫グロブリン
107 イオメプロール
108
ラサギリンメシル酸
塩
米国FDAは、エスモロールの添付文書を改訂したことを公
表した。改訂内容は以下のとおり。
①Contraindicationsの項にⅠ度を超える重度の房室ブロッ
クが追加された。また、非代償性心不全の項に心原性ショッ
クを引き起こすことがある旨の説明が追加された。また、静
アメリカ
注用Caチャネル拮抗剤との併用の項に心血管虚脱を引き
起こすことがある旨の説明が追加された。
②Warnings and Precautionsの項に、患者に心不全の徴候
や症状が現れた場合には、塩酸エスモロールの投与を中
止し、支持療法を開始する旨が追加された。
Alphanate(人von Willebrand因子/人血液凝固第VIII因子
製剤)の小児研究に関するpublic assessment reportにて、
Venoglobulin-S10%の回収情報が記載されている。措置内
容は以下のとおり。
ATC96-03試験におけるAlphanateの回収について、製造
販売業者はVenoglobulin-S10%の3ロットからそれぞれ1つの
バイアルにおいてカビ又は酵母菌が検出されたことから、
オランダ
1997年12月11日から1998年6月25日の間に該当の無菌充
填エリアで充填されていた全製品を予防措置として回収し
たことを明らかにした。同エリアにて充填されていた他の全
製品は、強化された無菌試験又は各バイアルの強化された
目視検査及び定期無菌試験に合格した。この説明は懸念
を生じさせるものではなく、現在承認されているAlphanateの
有効性及び安全性に影響を与えるような問題があったこと
を示唆するものではない。
加HCは、安全性レビューの結果、3歳未満の小児における
ヨード造影剤の使用には甲状腺機能低下症の潜在的リスク
があると結論づけ、添付文書を改訂し、3歳未満の小児の カナダ
甲状腺機能低下症のリスクに関する追加情報を提供し小児
のモニタリングを推奨することとした。
欧州CMDhは、クエチアピンの欧州添付文書にセロトニン作
動薬との併用によるセロトニン症候群に関する注意喚起を
追記するPRAC勧告を支持した。主な内容は以下のとおり。
・Special warnings and precautions for use、Interaction with
other medicinal products and other forms of interaction の
オランダ
項に、MAO阻害薬、選択的セロトニン再取り込み阻害薬
(SSRI)、セロトニン・ノルエピネフリン再取り込み阻害薬
(SNRI)又は三環系抗うつ薬などのセロトニン作動薬との併
用により、セロトニン症候群を引き起こす可能性がある旨を
追記する。
14/48
その他
本邦における
措置内容※2
対応済
注目
対応中
対応済
注目
添付文書改
訂(警告・禁 注目
忌)
回収
対応不要
その他
注目
その他
注目
(2024年4月1日~2024年7月31日)
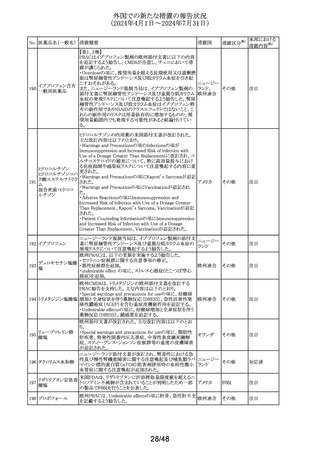
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
アルゼンチン当局より添付文書改訂の指示があった。
アルゼンチ
・Advertencias及びReacciones adversasの項に、亜硫酸塩
その他
ン
に対するアレルギー反応、過敏症反応が追記。
フロセミド
【第1報、第2報、第3報】
リシノプリル水和物 欧州EMAは、ヒト用医薬品中のニトロソアミン不純物に係る
101 デキストロメトルファ 意見書に関する販売承認取得者/申請者向けQ&Aを更新 欧州連合 その他
ン臭化水素酸塩水 し、各物質固有の一日許容摂取量とCPCA categoryを更新
和物
した。
南アフリカSAHPRA は、遺伝毒性のある医薬品の潜在的な
ドキソルビシン塩酸
胎児毒性、催奇形性について、南アフリカ添付文書を改訂 南アフリカ その他
102
塩
するよう求めた。
【第1報、第2報】
アモキシシリン水和 米国添付文書が改訂され、Warnings and Precautionsの項
アメリカ
その他
103
物
に、Drugs-Induced Enteroclitis Syndrome(DIES)が追記され
た。
100 エダラボン
104
105
タゾバクタム・ピペラシリンの米国添付文書が改訂され、
ピペラシリンナトリウ Adverse Reactionsの項に、「心筋梗塞を伴う、あるいは伴わ アメリカ、
ム
ない急性心筋虚血がアレルギー反応の一部として起こるこ 日本
とがある」及び「線状IgA水疱症」が追記された。
エスモロール塩酸
塩
乾燥スルホ化人免
疫グロブリン
106
乾燥ペプシン処理
人免疫グロブリン
107 イオメプロール
108
ラサギリンメシル酸
塩
米国FDAは、エスモロールの添付文書を改訂したことを公
表した。改訂内容は以下のとおり。
①Contraindicationsの項にⅠ度を超える重度の房室ブロッ
クが追加された。また、非代償性心不全の項に心原性ショッ
クを引き起こすことがある旨の説明が追加された。また、静
アメリカ
注用Caチャネル拮抗剤との併用の項に心血管虚脱を引き
起こすことがある旨の説明が追加された。
②Warnings and Precautionsの項に、患者に心不全の徴候
や症状が現れた場合には、塩酸エスモロールの投与を中
止し、支持療法を開始する旨が追加された。
Alphanate(人von Willebrand因子/人血液凝固第VIII因子
製剤)の小児研究に関するpublic assessment reportにて、
Venoglobulin-S10%の回収情報が記載されている。措置内
容は以下のとおり。
ATC96-03試験におけるAlphanateの回収について、製造
販売業者はVenoglobulin-S10%の3ロットからそれぞれ1つの
バイアルにおいてカビ又は酵母菌が検出されたことから、
オランダ
1997年12月11日から1998年6月25日の間に該当の無菌充
填エリアで充填されていた全製品を予防措置として回収し
たことを明らかにした。同エリアにて充填されていた他の全
製品は、強化された無菌試験又は各バイアルの強化された
目視検査及び定期無菌試験に合格した。この説明は懸念
を生じさせるものではなく、現在承認されているAlphanateの
有効性及び安全性に影響を与えるような問題があったこと
を示唆するものではない。
加HCは、安全性レビューの結果、3歳未満の小児における
ヨード造影剤の使用には甲状腺機能低下症の潜在的リスク
があると結論づけ、添付文書を改訂し、3歳未満の小児の カナダ
甲状腺機能低下症のリスクに関する追加情報を提供し小児
のモニタリングを推奨することとした。
欧州CMDhは、クエチアピンの欧州添付文書にセロトニン作
動薬との併用によるセロトニン症候群に関する注意喚起を
追記するPRAC勧告を支持した。主な内容は以下のとおり。
・Special warnings and precautions for use、Interaction with
other medicinal products and other forms of interaction の
オランダ
項に、MAO阻害薬、選択的セロトニン再取り込み阻害薬
(SSRI)、セロトニン・ノルエピネフリン再取り込み阻害薬
(SNRI)又は三環系抗うつ薬などのセロトニン作動薬との併
用により、セロトニン症候群を引き起こす可能性がある旨を
追記する。
14/48
その他
本邦における
措置内容※2
対応済
注目
対応中
対応済
注目
添付文書改
訂(警告・禁 注目
忌)
回収
対応不要
その他
注目
その他
注目