よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
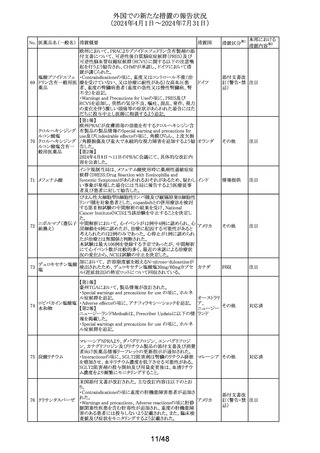
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
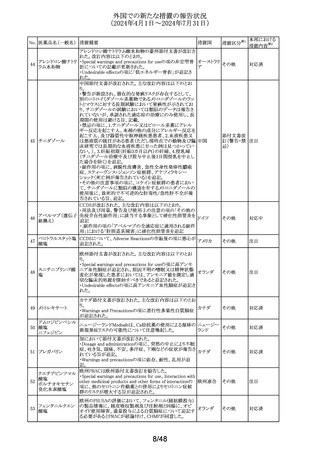
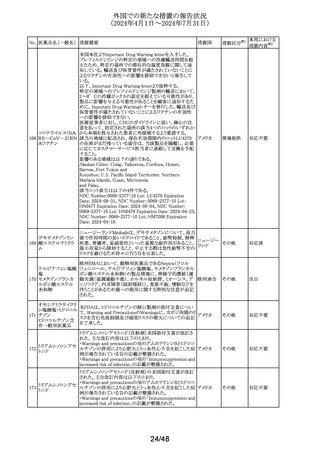
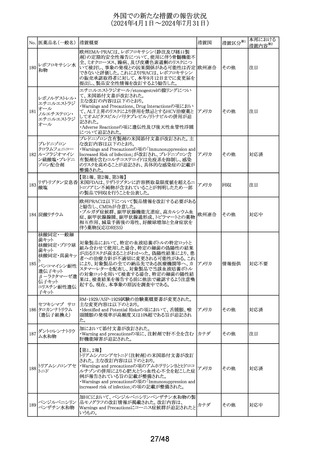
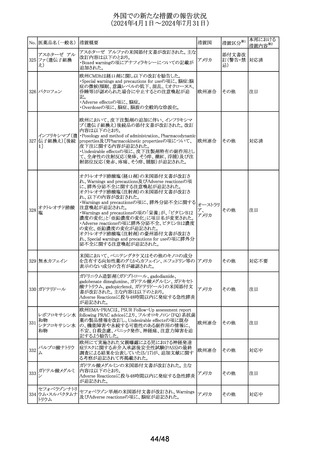
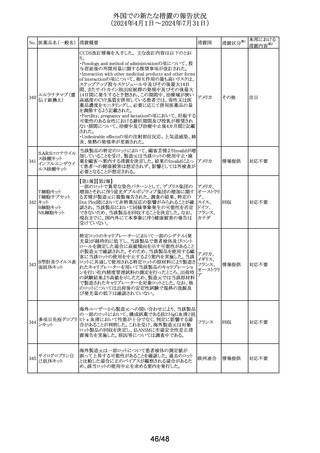
No. 医薬品名(一般名) 措置概要
137
ガドテル酸メグルミ
ン
措置国
【第1報】
Company Core Safety Information(CCSI)の改訂に伴い、フ
ランス及びスウェーデンの添付文書が改訂された。主な内
容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第2報】
Company Core Safety Information(CCSI)の改訂に伴い、
英国添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
ドイツ、
する情報が更新され、「ガドリニウムは胎盤を通過する可能
フランス、
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
スウェーデ
その他
するかどうかは不明である。」と追記された。
ン、
【第3報】
オランダ、
Company Core Safety Information(CCSI)の改訂に伴い、
イギリス
オランダ添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第4報】
Company Core Safety Information(CCSI)の改訂に伴い、ド
イツ添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第1-3報】
フェンタニル
豪TGAにおいて、製品情報が改訂された。
138 フェンタニルクエン
・Special warnings and precautions for use の項に、高プロ
酸塩
ラクチン血症、副腎機能不全を追記。
139 レトロゾール
措置区分※1
オーストラリ
その他
ア
【第1報、第2報、第3報】
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
オーストラリ
その他
・Special warnings and precautions for useの項に腱障害が ア
追加され、第3世代アロマターゼ阻害剤は、腱炎、腱鞘炎と
関連があり、腱断裂が潜在的なリスクであると記載された。
オマーン、クウェート、バーレーン及びアラブ首長国連邦に
アベルマブ(遺伝子
発送された製剤において、粒子状物質(ステンレス鋼粒子) ドイツ
組換え)
が検出されたため、該当する製品の回収を実施した。
米国FDAは添付文書の改訂を指示した。変更内容は以下
のとおり。
・ WARNINGS AND PRECAUTIONSの項に「湿疹性発疹」
の項を追加し、市販後においてアトピー性皮膚炎様発疹を
ブロダルマブ(遺伝
141
含む重度の湿疹性発疹の症例が認められ、初回投与から アメリカ
子組換え)
数日から数カ月後の発症であり、重篤で入院を要した症例
もあった旨等を記載する。
・ADVERSE REACTIONSのPostmarketing Experienceの項
に、湿疹性発疹(アトピー性皮膚炎様発疹)を追記する。
140
20/48
本邦における
措置内容※2
注目
対応中
注目
回収
対応不要
その他
注目
(2024年4月1日~2024年7月31日)
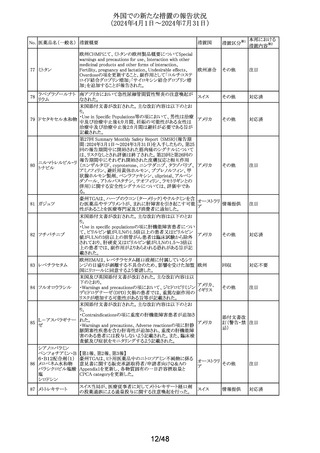
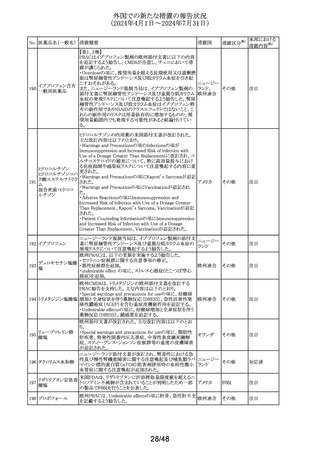
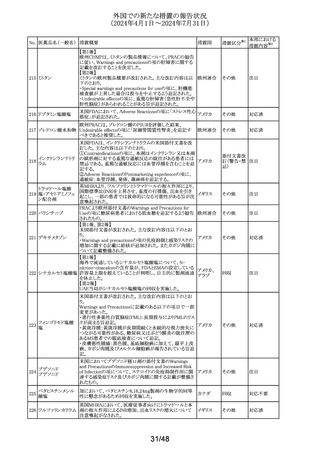
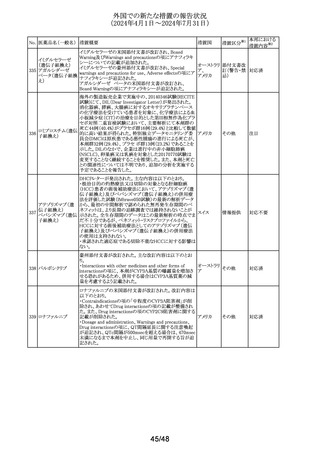
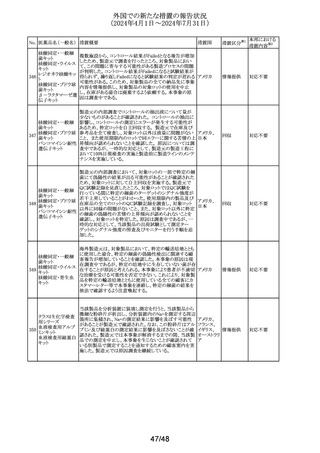
No. 医薬品名(一般名) 措置概要
137
ガドテル酸メグルミ
ン
措置国
【第1報】
Company Core Safety Information(CCSI)の改訂に伴い、フ
ランス及びスウェーデンの添付文書が改訂された。主な内
容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第2報】
Company Core Safety Information(CCSI)の改訂に伴い、
英国添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
ドイツ、
する情報が更新され、「ガドリニウムは胎盤を通過する可能
フランス、
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
スウェーデ
その他
するかどうかは不明である。」と追記された。
ン、
【第3報】
オランダ、
Company Core Safety Information(CCSI)の改訂に伴い、
イギリス
オランダ添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第4報】
Company Core Safety Information(CCSI)の改訂に伴い、ド
イツ添付文書が改訂された。主な内容は以下のとおり。
・Special warnings and precautions for useの項において、
髄腔内投与では使用しない旨の注意喚起に「生命を脅か
す重篤な致命的症例が髄腔内投与で報告されている。」と
追記された。
・Fertility, pregnancy and lactationの項において妊婦に関
する情報が更新され、「ガドリニウムは胎盤を通過する可能
性がある。ガドリニウムへの曝露が胎児への悪影響と関連
するかどうかは不明である。」と追記された。
【第1-3報】
フェンタニル
豪TGAにおいて、製品情報が改訂された。
138 フェンタニルクエン
・Special warnings and precautions for use の項に、高プロ
酸塩
ラクチン血症、副腎機能不全を追記。
139 レトロゾール
措置区分※1
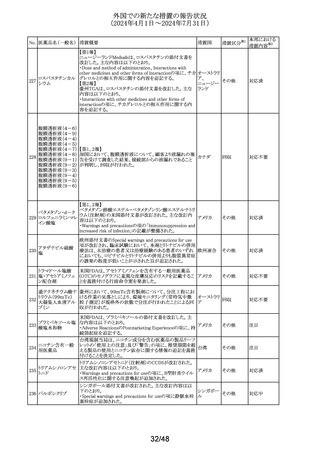
オーストラリ
その他
ア
【第1報、第2報、第3報】
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
オーストラリ
その他
・Special warnings and precautions for useの項に腱障害が ア
追加され、第3世代アロマターゼ阻害剤は、腱炎、腱鞘炎と
関連があり、腱断裂が潜在的なリスクであると記載された。
オマーン、クウェート、バーレーン及びアラブ首長国連邦に
アベルマブ(遺伝子
発送された製剤において、粒子状物質(ステンレス鋼粒子) ドイツ
組換え)
が検出されたため、該当する製品の回収を実施した。
米国FDAは添付文書の改訂を指示した。変更内容は以下
のとおり。
・ WARNINGS AND PRECAUTIONSの項に「湿疹性発疹」
の項を追加し、市販後においてアトピー性皮膚炎様発疹を
ブロダルマブ(遺伝
141
含む重度の湿疹性発疹の症例が認められ、初回投与から アメリカ
子組換え)
数日から数カ月後の発症であり、重篤で入院を要した症例
もあった旨等を記載する。
・ADVERSE REACTIONSのPostmarketing Experienceの項
に、湿疹性発疹(アトピー性皮膚炎様発疹)を追記する。
140
20/48
本邦における
措置内容※2
注目
対応中
注目
回収
対応不要
その他
注目