よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (45 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
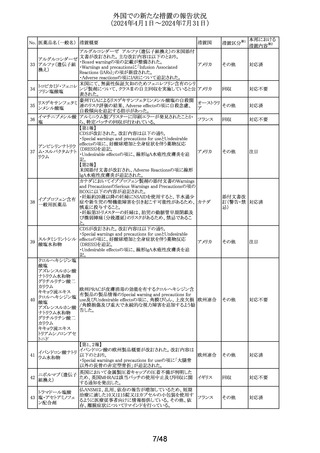
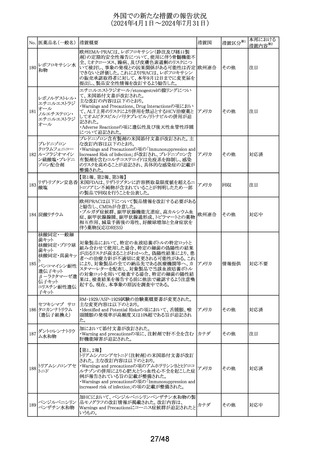
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
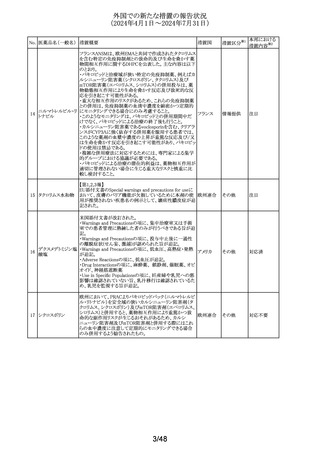
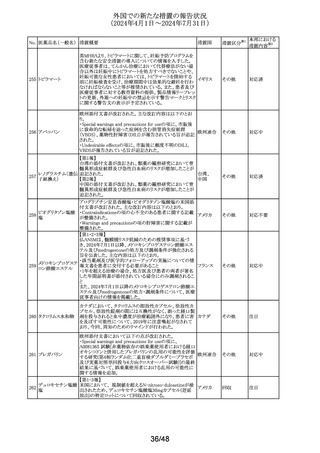
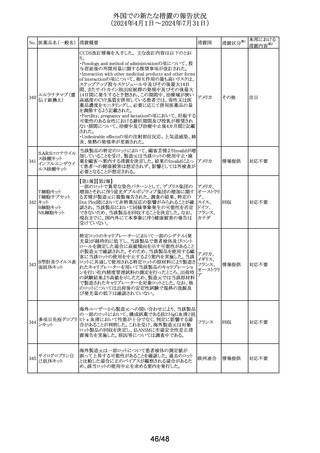
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
イミグルセラーゼの米国添付文書が改訂され、Boxed
Warning及びWarnings and precautionsの項にアナフィラキ
イミグルセラーゼ
シーについての記載が追加された。
(遺伝子組換え)
オーストラリ 添付文書改
イミグルセラーゼの豪州添付文書が改訂され、Special
335 アガルシダーゼ
ア、
訂(警告・禁 対応済
warnings and precautions for use、Adverse effectsの項にア
ベータ(遺伝子組換
アメリカ
忌)
ナフィラキシーが追記された。
え)
アガルシダーゼ ベータの米国添付文書が改訂され、
Boxed Warningの項にアナフィラキシーが追記された。
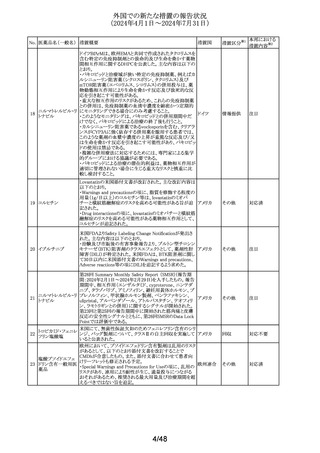
海外の製造販売企業で実施中の、20140346試験(RECITE
試験)にて、DIL(Dear Investigator Letter)が発出された。
消化器癌、膵癌、大腸癌に対するオキサリプラチンベース
の化学療法を受けている患者を対象に、化学療法による血
小板減少症(CIT)の治療を目的とした第III相無作為化プラ
セボ対照二重盲検試験において、主要解析にて本剤群の
死亡44例(40.4%)がプラセボ群16例(29.4%)と比較して数値
ロミプロスチム(遺伝
336
的に高い結果が得られた。特別独立データモニタリング委 アメリカ
子組換え)
員会(DMC)は原疾患である悪性腫瘍の進行による死亡が、
本剤群32例(29.4%)、プラセ ボ群13例(23.2%)であることを
示した。DILのなかで、企業は進行中の非小細胞肺癌
(NSCLC)、卵巣癌又は乳癌を対象とした20170770試験は
変更することなく継続することを推奨した。また、本剤と死亡
との関連性については不明であり、追加の分析を実施する
予定であることを報告した。
その他
注目
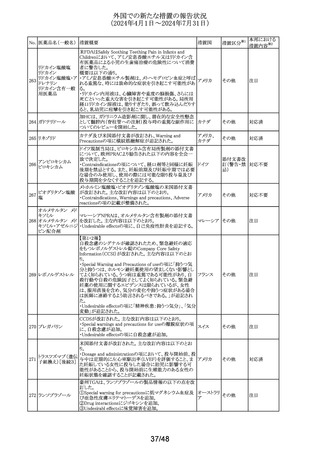
DHCPレターが発出された。主な内容は以下のとおり。
・根治目的の灼熱療法又は切除の対象となる肝細胞癌
(HCC)患者の術後補助療法において、アテゾリズマブ(遺
伝子組換え)及びベバシズマブ(遺伝子組換え)の併用療
法を評価した試験(IMbrave050試験)の最新の解析データ
アテゾリズマブ(遺 から、最初の中間解析で認められた無再発生存期間のベ
伝子組換え)
ネフィットは、より長期の追跡調査では維持されないことが
スイス
337
ベバシズマブ(遺伝 示された。全生存期間のデータはこの最新解析の時点でま
子組換え)
だ不十分であるが、ベネフィット・リスクプロファイルから、
HCCに対する術後補助療法としてのアテゾリズマブ(遺伝
子組換え)及びベバシズマブ(遺伝子組換え)の併用療法
の使用は支持されない。
・承認された適応症である切除不能なHCCに対する影響は
ない。
情報提供
対応不要
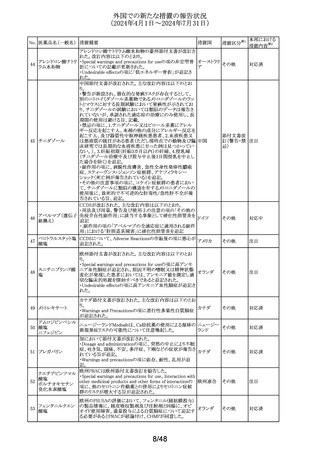
338 パルボシクリブ
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Interactions with other medicines and other forms of
オーストラリ
その他
interactionsの項に、本剤がCYP3A基質の曝露量を増加さ ア
せる恐れがあるため、併用する場合はCYP3A基質薬の減
量を考慮するよう記載された。
対応済
339 ロナファルニブ
ロナファルニブの米国添付文書が改訂された。改訂内容は
以下のとおり。
・Contraindicationsの項の「中程度のCYP3A阻害剤」が削
除され、あわせてDrug interactionsの項の記載が整備され
た。また、Drug interactionsの項のCYP2C9阻害剤に関する
記載が削除された。
アメリカ
・Dosage and administration、Warnings and precautions、
Drug interactionsの項に、QT間隔延長に関する注意喚起
が追記され、QTc間隔が500msecを超える場合は、470msec
未満になるまで本剤を中止し、同じ用量で再開する旨が追
記された。
対応済
45/48
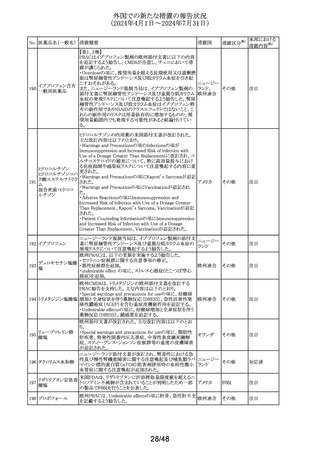
その他
(2024年4月1日~2024年7月31日)
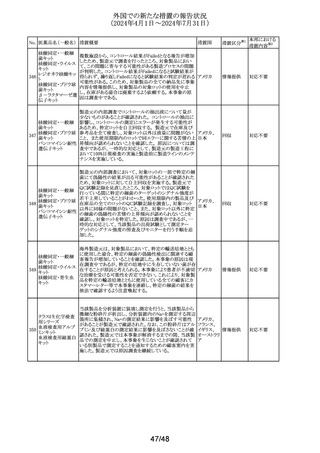
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
イミグルセラーゼの米国添付文書が改訂され、Boxed
Warning及びWarnings and precautionsの項にアナフィラキ
イミグルセラーゼ
シーについての記載が追加された。
(遺伝子組換え)
オーストラリ 添付文書改
イミグルセラーゼの豪州添付文書が改訂され、Special
335 アガルシダーゼ
ア、
訂(警告・禁 対応済
warnings and precautions for use、Adverse effectsの項にア
ベータ(遺伝子組換
アメリカ
忌)
ナフィラキシーが追記された。
え)
アガルシダーゼ ベータの米国添付文書が改訂され、
Boxed Warningの項にアナフィラキシーが追記された。
海外の製造販売企業で実施中の、20140346試験(RECITE
試験)にて、DIL(Dear Investigator Letter)が発出された。
消化器癌、膵癌、大腸癌に対するオキサリプラチンベース
の化学療法を受けている患者を対象に、化学療法による血
小板減少症(CIT)の治療を目的とした第III相無作為化プラ
セボ対照二重盲検試験において、主要解析にて本剤群の
死亡44例(40.4%)がプラセボ群16例(29.4%)と比較して数値
ロミプロスチム(遺伝
336
的に高い結果が得られた。特別独立データモニタリング委 アメリカ
子組換え)
員会(DMC)は原疾患である悪性腫瘍の進行による死亡が、
本剤群32例(29.4%)、プラセ ボ群13例(23.2%)であることを
示した。DILのなかで、企業は進行中の非小細胞肺癌
(NSCLC)、卵巣癌又は乳癌を対象とした20170770試験は
変更することなく継続することを推奨した。また、本剤と死亡
との関連性については不明であり、追加の分析を実施する
予定であることを報告した。
その他
注目
DHCPレターが発出された。主な内容は以下のとおり。
・根治目的の灼熱療法又は切除の対象となる肝細胞癌
(HCC)患者の術後補助療法において、アテゾリズマブ(遺
伝子組換え)及びベバシズマブ(遺伝子組換え)の併用療
法を評価した試験(IMbrave050試験)の最新の解析データ
アテゾリズマブ(遺 から、最初の中間解析で認められた無再発生存期間のベ
伝子組換え)
ネフィットは、より長期の追跡調査では維持されないことが
スイス
337
ベバシズマブ(遺伝 示された。全生存期間のデータはこの最新解析の時点でま
子組換え)
だ不十分であるが、ベネフィット・リスクプロファイルから、
HCCに対する術後補助療法としてのアテゾリズマブ(遺伝
子組換え)及びベバシズマブ(遺伝子組換え)の併用療法
の使用は支持されない。
・承認された適応症である切除不能なHCCに対する影響は
ない。
情報提供
対応不要
338 パルボシクリブ
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Interactions with other medicines and other forms of
オーストラリ
その他
interactionsの項に、本剤がCYP3A基質の曝露量を増加さ ア
せる恐れがあるため、併用する場合はCYP3A基質薬の減
量を考慮するよう記載された。
対応済
339 ロナファルニブ
ロナファルニブの米国添付文書が改訂された。改訂内容は
以下のとおり。
・Contraindicationsの項の「中程度のCYP3A阻害剤」が削
除され、あわせてDrug interactionsの項の記載が整備され
た。また、Drug interactionsの項のCYP2C9阻害剤に関する
記載が削除された。
アメリカ
・Dosage and administration、Warnings and precautions、
Drug interactionsの項に、QT間隔延長に関する注意喚起
が追記され、QTc間隔が500msecを超える場合は、470msec
未満になるまで本剤を中止し、同じ用量で再開する旨が追
記された。
対応済
45/48
その他