よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
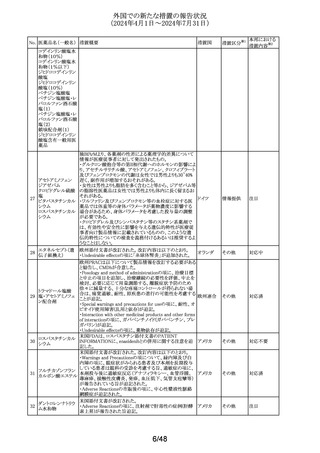
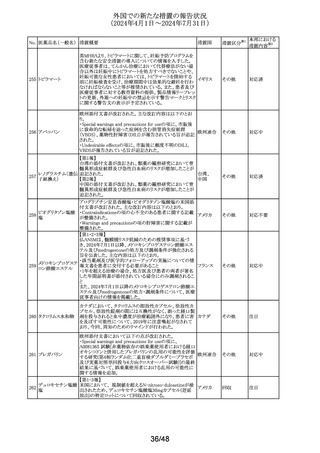
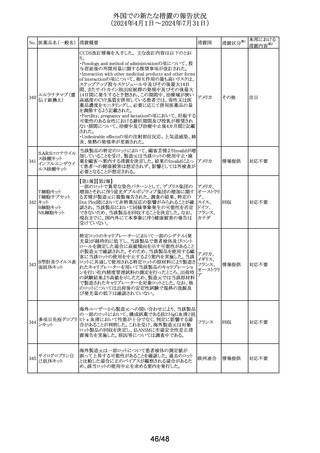
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
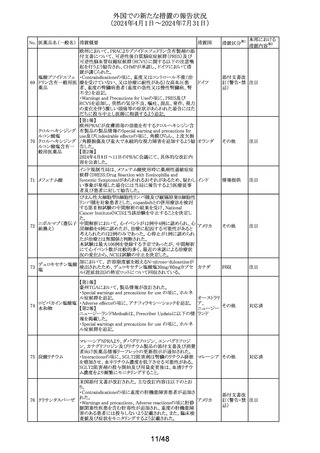
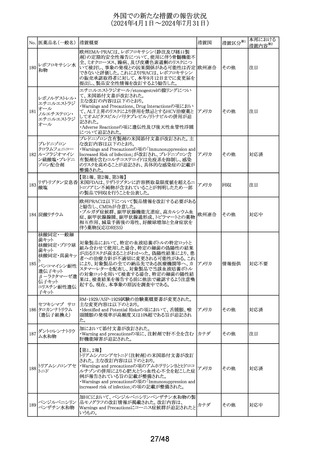
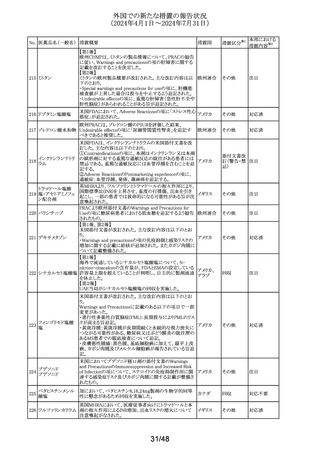
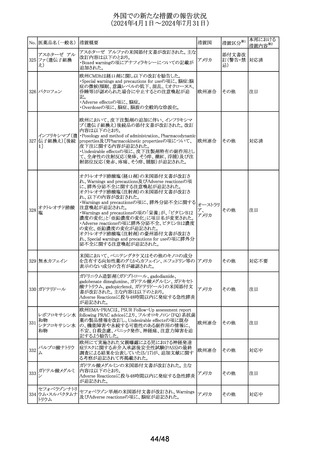
No. 医薬品名(一般名) 措置概要
措置国
欧州CMDhは、アトルバスタチンの欧州添付文書を改訂す
アトルバスタチンカ るPRAC勧告を支持した。主な内容は以下のとおり。
ルシウム水和物
・Special warnings and precautions for use、Interaction with
アムロジピンベシル other medicinal products and other forms of interactionの
303
欧州連合
酸塩・アトルバスタ 項に、ダプトマイシンとの併用によるミオパチー、横紋筋融
チンカルシウム水和 解症のリスク増加について追記する。
物配合剤(1)
・Undesirable effectsの項に、血管炎、苔癬様薬物反応を追
記する。
304 ゲムシタビン塩酸塩
輸液バッグに断続的に少量の漏れが見つかり、特定のバッ
イギリス
チをリコールしている。
措置区分※1
本邦における
措置内容※2
その他
対応中
回収
対応不要
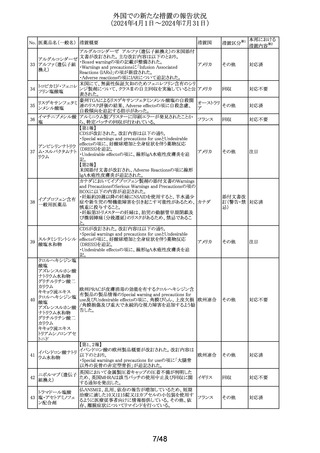
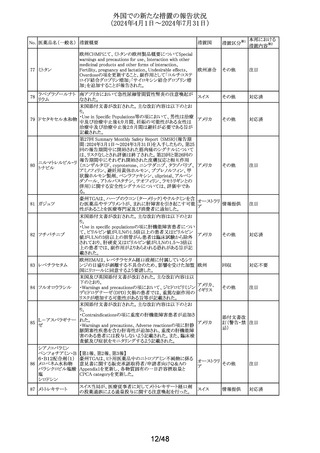
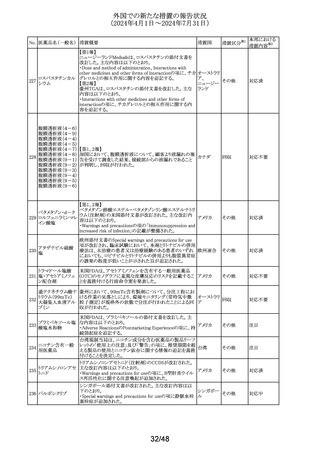
豪州において、イブプロフェン含有製剤の添付文書が改訂
された。改訂内容は以下のとおり。
イブプロフェン含有 ・Warnings and Precautions for Use、Adverse Effects
オーストラリ
305
その他
一般用医薬品
(undesirable Effects)及びOverdoseの項に腎尿細管性アシ ア
ドーシス及び重篤な低カリウム血症が起こるおそれがある旨
が追記された。
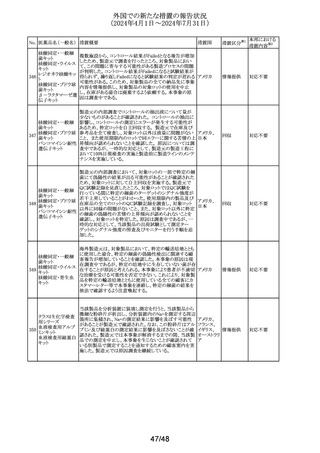
英国添付文書が改訂された。
・Special warnings and precautions for use、Interaction with
クエチアピンフマル
306
other medicinal products and other forms of interactionの イギリス
その他
酸塩
項に、他のセロトニン作動薬との併用によりセロトニン症候
群のリスクが増大する旨が追記された。
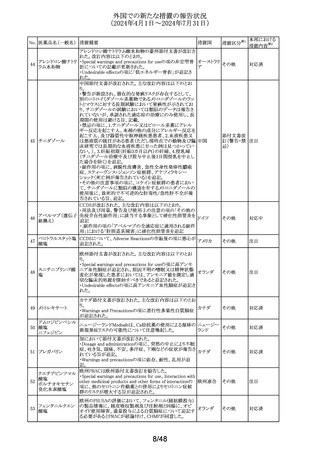
ラベプラゾールナト
リウム・アモキシシリ
ン水和物・クラリスロ スイスにおいて、密閉が不十分なため粉末が漏出し、不正
マイシン
確な投与量につながる可能性があるとして、Spirig
スイス
回収
307
ラベプラゾールナト Healthcare AGのアモキシシリン経口懸濁用粉末の特定ロ
リウム・アモキシシリ バッチが回収されている。
ン水和物・メトロニダ
ゾール
セルリポナーゼ アルファの米国添付文書が改訂された。
主な改訂内容は以下のとおり。
セルリポナーゼ ア ・Boxed warning及びWarnings and precautionsの項に、治
308 ルファ(遺伝子組換 療の初期及び終了後にアナフィラキシーが発生した旨及び アメリカ
その他
え)
適切な管理下において投与を開始すること、重度の過敏症
反応が発生した場合の対処法に関する記載が追記され
た。
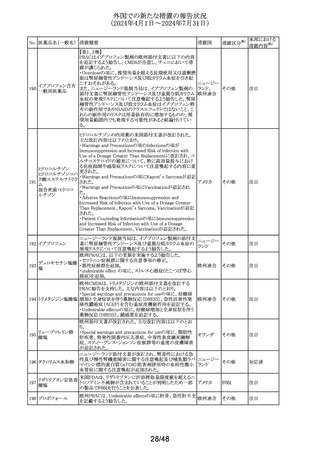
309 アセトアミノフェン
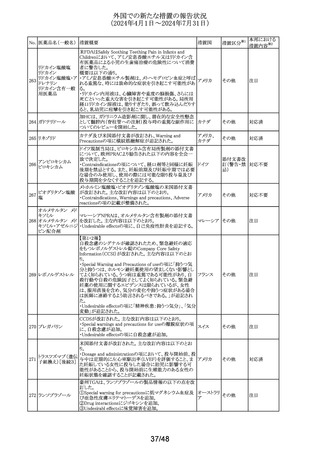
310
テトラコサクチド酢
酸塩〔持続性〕
テトラコサクチド酢
酸塩
注目
注目
対応不要
対応済
アイルランド規制当局は、医療従事者に対して、アセトアミノ
フェンの肝毒性の発現リスクが高い患者への使用に際して
注意喚起を行った。主な注意喚起内容は以下のとおり。
・肝毒性の発現リスクが高い患者では、承認用量の範囲内
の用量であっても肝毒性が発現する可能性がある。
・肝毒性の発現リスクが高い患者として、低体重、低BMI、
栄養失調、脱水、慢性アルコール中毒、腎障害又は肝障 アイルラン
害合併の患者が含まれる。グルタチオン欠乏又は減少の素 ド、
情報提供
因となりうる条件を有する患者、及び肝毒性のある薬物を併 フランス
用している患者もリスクがあると考えられる。
・肝毒性の発現リスクが高い患者においては、より低い用量
で開始する、投与量を減量する、投与間隔を延長すること
を考慮する。
また、フランスにおいて、外箱が改訂され、過剰摂取は肝毒
性を引き起こす旨が記載された。
対応済
テトラコサクチドの米国添付文書が改訂された。主な改訂内
容は以下のとおり。
・Contraindicationsの項に、過敏症はアナフィラキシーを含
む旨が追記された。
・Warnings and precautionsの項の「Diagnostic
Inaccuracies」に、患者が特定の薬剤を服用している場合、 アメリカ
コルチゾール結合グロブリンに対する影響により、本剤投与
後のコルチゾール値及び副腎皮質機能不全の診断が不正
確になる可能性がある旨の記載が整備された。
・Adverse reactionsの項に、「過敏症反応」「診断の不正確
性」が追記された。
注目
41/48
その他
(2024年4月1日~2024年7月31日)
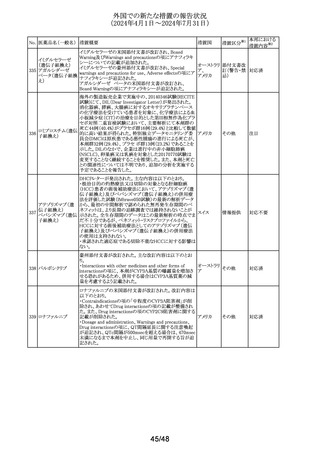
No. 医薬品名(一般名) 措置概要
措置国
欧州CMDhは、アトルバスタチンの欧州添付文書を改訂す
アトルバスタチンカ るPRAC勧告を支持した。主な内容は以下のとおり。
ルシウム水和物
・Special warnings and precautions for use、Interaction with
アムロジピンベシル other medicinal products and other forms of interactionの
303
欧州連合
酸塩・アトルバスタ 項に、ダプトマイシンとの併用によるミオパチー、横紋筋融
チンカルシウム水和 解症のリスク増加について追記する。
物配合剤(1)
・Undesirable effectsの項に、血管炎、苔癬様薬物反応を追
記する。
304 ゲムシタビン塩酸塩
輸液バッグに断続的に少量の漏れが見つかり、特定のバッ
イギリス
チをリコールしている。
措置区分※1
本邦における
措置内容※2
その他
対応中
回収
対応不要
豪州において、イブプロフェン含有製剤の添付文書が改訂
された。改訂内容は以下のとおり。
イブプロフェン含有 ・Warnings and Precautions for Use、Adverse Effects
オーストラリ
305
その他
一般用医薬品
(undesirable Effects)及びOverdoseの項に腎尿細管性アシ ア
ドーシス及び重篤な低カリウム血症が起こるおそれがある旨
が追記された。
英国添付文書が改訂された。
・Special warnings and precautions for use、Interaction with
クエチアピンフマル
306
other medicinal products and other forms of interactionの イギリス
その他
酸塩
項に、他のセロトニン作動薬との併用によりセロトニン症候
群のリスクが増大する旨が追記された。
ラベプラゾールナト
リウム・アモキシシリ
ン水和物・クラリスロ スイスにおいて、密閉が不十分なため粉末が漏出し、不正
マイシン
確な投与量につながる可能性があるとして、Spirig
スイス
回収
307
ラベプラゾールナト Healthcare AGのアモキシシリン経口懸濁用粉末の特定ロ
リウム・アモキシシリ バッチが回収されている。
ン水和物・メトロニダ
ゾール
セルリポナーゼ アルファの米国添付文書が改訂された。
主な改訂内容は以下のとおり。
セルリポナーゼ ア ・Boxed warning及びWarnings and precautionsの項に、治
308 ルファ(遺伝子組換 療の初期及び終了後にアナフィラキシーが発生した旨及び アメリカ
その他
え)
適切な管理下において投与を開始すること、重度の過敏症
反応が発生した場合の対処法に関する記載が追記され
た。
309 アセトアミノフェン
310
テトラコサクチド酢
酸塩〔持続性〕
テトラコサクチド酢
酸塩
注目
注目
対応不要
対応済
アイルランド規制当局は、医療従事者に対して、アセトアミノ
フェンの肝毒性の発現リスクが高い患者への使用に際して
注意喚起を行った。主な注意喚起内容は以下のとおり。
・肝毒性の発現リスクが高い患者では、承認用量の範囲内
の用量であっても肝毒性が発現する可能性がある。
・肝毒性の発現リスクが高い患者として、低体重、低BMI、
栄養失調、脱水、慢性アルコール中毒、腎障害又は肝障 アイルラン
害合併の患者が含まれる。グルタチオン欠乏又は減少の素 ド、
情報提供
因となりうる条件を有する患者、及び肝毒性のある薬物を併 フランス
用している患者もリスクがあると考えられる。
・肝毒性の発現リスクが高い患者においては、より低い用量
で開始する、投与量を減量する、投与間隔を延長すること
を考慮する。
また、フランスにおいて、外箱が改訂され、過剰摂取は肝毒
性を引き起こす旨が記載された。
対応済
テトラコサクチドの米国添付文書が改訂された。主な改訂内
容は以下のとおり。
・Contraindicationsの項に、過敏症はアナフィラキシーを含
む旨が追記された。
・Warnings and precautionsの項の「Diagnostic
Inaccuracies」に、患者が特定の薬剤を服用している場合、 アメリカ
コルチゾール結合グロブリンに対する影響により、本剤投与
後のコルチゾール値及び副腎皮質機能不全の診断が不正
確になる可能性がある旨の記載が整備された。
・Adverse reactionsの項に、「過敏症反応」「診断の不正確
性」が追記された。
注目
41/48
その他