よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
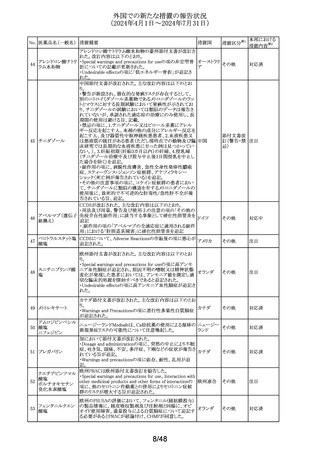
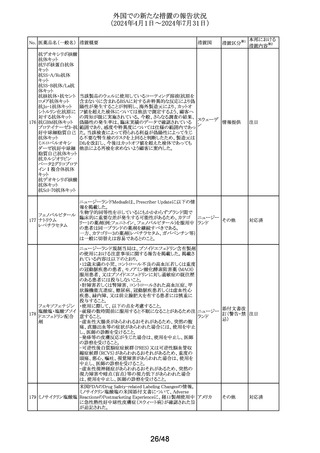
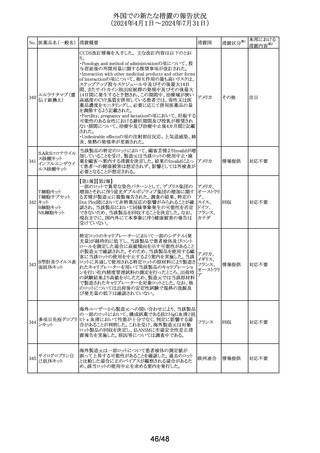
No. 医薬品名(一般名) 措置概要
措置国
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に重篤な皮膚副作用とし
199 ゲムシタビン塩酸塩 て、スティーヴンス・ジョンソン症候群、中毒性表皮壊死融 アメリカ
解症、好酸球増加と全身症状を伴う薬物反応、急性汎発性
発疹性膿疱症等が報告されており、重篤な皮膚副作用が
発現した場合は投与を中止するよう記載された。
措置区分※1
本邦における
措置内容※2
その他
対応中
ニュージーランドMedsafeのPrescriber Updateに、レボチロ
キシンの先発品から後発品への切り替え時の対応につい
て、処方者に対する注意喚起の情報が掲載された。
レボチロキシンナトリ ・ニュージーランドで承認されたジェネリック医薬品は、それ ニュージー
200
情報提供
ウム水和物
ぞれの新薬又は先発医薬品と生物学的に同等である。
ランド
・生物学的同等性は「切り替えが可能であること」を直接示
すものではない。特定の医薬品については、別の製品に切
り替える際に特別な注意が必要である。
ニュージーランドにおいて、タクロリムスのカプセル剤の添
付文書の以下の点が改訂された。
①Special warnings for precautions for useに日和見感染の
例として「CMV感染」を追加、腎毒性に関する記載整備、
mTOR阻害剤との相互作用に関する注意喚起の追加。
②相互作用の項の以下の点を改訂。
・CYP3A4を阻害又は誘発することが知られている薬剤又は
生薬に関する警告とアドバイスを追加
・相互作用薬としてHCVプロテアーゼ阻害剤 (テラプレビ
ニュージー
201 タクロリムス水和物 ル、ボセプレビルなど)、CMV抗ウイルス薬レテルモビル及
その他
ランド
びアミオダロン、生薬南五味子抽出物及びカスポファンギン
を追加
・ミコフェノール酸(MPA)製品による治療と併用する場合の
その他の考慮事項、及び直接作用型抗ウイルス薬(DAA)
治療の影響を追加
③Undesirabl effectsにCMV感染、血栓性微小血管症、無
顆粒球症、溶血性貧血、赤芽球癆、発熱性好中球減少
症、視神経症、可逆性後白質脳症症候群、カルシニューリ
ン阻害剤誘発疼痛症候群を追加
米国においてデキサメタゾン経口剤の添付文書が改訂され
た。改訂内容は以下のとおり。
・Warnings and PrecautionsのImmunosuppression and
202 デキサメタゾン
アメリカ
その他
Increased Risk of Infectionの項について、ステロイドの免疫
抑制作用に関連する感染症リスク及びカポジ肉腫に関する
記載が整備された。
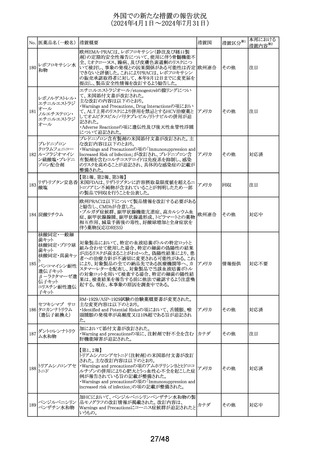
【第1報】
欧州PRACが皮膚消毒の効能を有するクロルヘキシジン含
有製品の製品情報のSpecial warning and precautions for
use及びUndesirable effectsの項に、角膜びらん、上皮欠損
クロルヘキシジング
ドイツ、
203
/角膜損傷及び重大で永続的な視力障害を追加するよう勧
その他
ルコン酸塩
欧州連合
告した。
【第2報】
ドイツBfArM発行の医薬品安全性情報に、上記EU EMAの
PRACの推奨事項が掲載された。
加において添付文書が改訂された。
・Serious Warnings and Precautionsの項に、抗うつ薬の使
用により自傷、他傷、自殺念慮及び自殺行動のリスクが増
ボルチオキセチン 加すること、これらリスクの発現を注意深く監視するよう追
204
カナダ
その他
臭化水素酸塩
記。
・Warnings and Precautionsの項に記載のあるセロトニン症
候群の一部変更及び性機能障害(中止後も症状継続する
旨を含む)が追記。
米国FDAがアセトアミノフェン含有OTC製剤の添付文書に
以下を記載することを検討している。
非ピリン系感冒剤 ・Warningsの項に、皮膚粘膜眼症候群(SJS)、中毒性表皮
205 (4)
融解症(TEN)及び急性汎発性発疹性膿疱症(AGEP)等の アメリカ
その他
アセトアミノフェン
重篤な皮膚反応を引き起こすおそれがあるため、皮膚の発
赤、水疱又は発疹等がみられた場合には速やかに医師に
相談するよう追記する。
29/48
対応不要
対応不要
対応不要
注目
注目
対応済
(2024年4月1日~2024年7月31日)
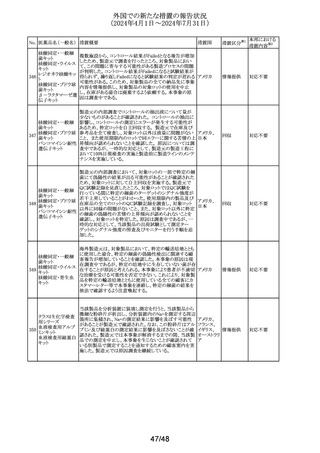
No. 医薬品名(一般名) 措置概要
措置国
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に重篤な皮膚副作用とし
199 ゲムシタビン塩酸塩 て、スティーヴンス・ジョンソン症候群、中毒性表皮壊死融 アメリカ
解症、好酸球増加と全身症状を伴う薬物反応、急性汎発性
発疹性膿疱症等が報告されており、重篤な皮膚副作用が
発現した場合は投与を中止するよう記載された。
措置区分※1
本邦における
措置内容※2
その他
対応中
ニュージーランドMedsafeのPrescriber Updateに、レボチロ
キシンの先発品から後発品への切り替え時の対応につい
て、処方者に対する注意喚起の情報が掲載された。
レボチロキシンナトリ ・ニュージーランドで承認されたジェネリック医薬品は、それ ニュージー
200
情報提供
ウム水和物
ぞれの新薬又は先発医薬品と生物学的に同等である。
ランド
・生物学的同等性は「切り替えが可能であること」を直接示
すものではない。特定の医薬品については、別の製品に切
り替える際に特別な注意が必要である。
ニュージーランドにおいて、タクロリムスのカプセル剤の添
付文書の以下の点が改訂された。
①Special warnings for precautions for useに日和見感染の
例として「CMV感染」を追加、腎毒性に関する記載整備、
mTOR阻害剤との相互作用に関する注意喚起の追加。
②相互作用の項の以下の点を改訂。
・CYP3A4を阻害又は誘発することが知られている薬剤又は
生薬に関する警告とアドバイスを追加
・相互作用薬としてHCVプロテアーゼ阻害剤 (テラプレビ
ニュージー
201 タクロリムス水和物 ル、ボセプレビルなど)、CMV抗ウイルス薬レテルモビル及
その他
ランド
びアミオダロン、生薬南五味子抽出物及びカスポファンギン
を追加
・ミコフェノール酸(MPA)製品による治療と併用する場合の
その他の考慮事項、及び直接作用型抗ウイルス薬(DAA)
治療の影響を追加
③Undesirabl effectsにCMV感染、血栓性微小血管症、無
顆粒球症、溶血性貧血、赤芽球癆、発熱性好中球減少
症、視神経症、可逆性後白質脳症症候群、カルシニューリ
ン阻害剤誘発疼痛症候群を追加
米国においてデキサメタゾン経口剤の添付文書が改訂され
た。改訂内容は以下のとおり。
・Warnings and PrecautionsのImmunosuppression and
202 デキサメタゾン
アメリカ
その他
Increased Risk of Infectionの項について、ステロイドの免疫
抑制作用に関連する感染症リスク及びカポジ肉腫に関する
記載が整備された。
【第1報】
欧州PRACが皮膚消毒の効能を有するクロルヘキシジン含
有製品の製品情報のSpecial warning and precautions for
use及びUndesirable effectsの項に、角膜びらん、上皮欠損
クロルヘキシジング
ドイツ、
203
/角膜損傷及び重大で永続的な視力障害を追加するよう勧
その他
ルコン酸塩
欧州連合
告した。
【第2報】
ドイツBfArM発行の医薬品安全性情報に、上記EU EMAの
PRACの推奨事項が掲載された。
加において添付文書が改訂された。
・Serious Warnings and Precautionsの項に、抗うつ薬の使
用により自傷、他傷、自殺念慮及び自殺行動のリスクが増
ボルチオキセチン 加すること、これらリスクの発現を注意深く監視するよう追
204
カナダ
その他
臭化水素酸塩
記。
・Warnings and Precautionsの項に記載のあるセロトニン症
候群の一部変更及び性機能障害(中止後も症状継続する
旨を含む)が追記。
米国FDAがアセトアミノフェン含有OTC製剤の添付文書に
以下を記載することを検討している。
非ピリン系感冒剤 ・Warningsの項に、皮膚粘膜眼症候群(SJS)、中毒性表皮
205 (4)
融解症(TEN)及び急性汎発性発疹性膿疱症(AGEP)等の アメリカ
その他
アセトアミノフェン
重篤な皮膚反応を引き起こすおそれがあるため、皮膚の発
赤、水疱又は発疹等がみられた場合には速やかに医師に
相談するよう追記する。
29/48
対応不要
対応不要
対応不要
注目
注目
対応済