よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
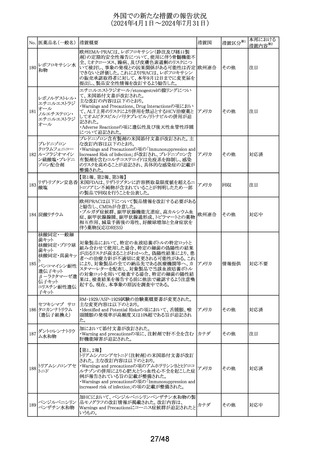
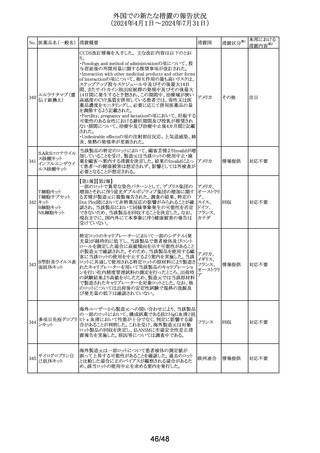
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
豪TGAは本剤の添付文書のAdverse Effectsの項にギラン・
バレー症候群(GBS)及び回転性めまいを含める更新を要
請した。 主な内容は以下の通り。
GBS:
2024年5月6日時点でTGAの有害事象管理システム
(AEMS)データベースにおいて「組み換え水痘帯状疱疹ウ
イルス糖蛋白質E抗原」と反応語「ギラン・バレー症候群」を
検索したところ、現地症例計5例のうち3例は単一被疑症例
であった。さらに、2024年5月6日にWHOのグローバル有害
事象データベースであるVigiBaseを検索したところ、「水痘
帯状疱疹ワクチン(AI)」と「ギラン・バレー症候群(PT)」を関
連付ける708例を発見し、549例が単一被疑症例、陽性
IC025値は2.4であった。708例のうち、509例が「シングリック
ス(TN)」で、陽性IC025値は3.3と報告されている。
オーストラリアの現行添付文書には、Special Warning and
Precautions for Useの項にGBSについて「65歳以上個人を
対象とした市販後観察研究において、本剤接種後42日間
にGBSリスク増加(投与100万回当たり推定3例余り)が観察
された。入手可能な情報は、本剤との因果関係を確定する
には不十分である」と記載されているが、Adverse Effectsの
項において予防接種後有害事象として言及していない。
米国及びカナダの添付文書には、Warnings and
Precautions、Adverse Reactions及び Postmarketing
Experienceの項に、本剤接種後のGBS潜在リスクに関する
市販後観察研究に関する段落があり、本剤接種後42日間
のGBSリスク上昇を強調している。
乾燥組換え帯状疱
市販後現地及び海外症例が報告されていること、並びに、
疹ワクチン(チャイ
オーストラリ
244
国際市販後観察研究において本剤接種後のGBS発現エビ
その他
ニーズハムスター卵
ア
デンスが報告されていることを踏まえ、Adverse Effectsの項
巣細胞由来)
への有害事象追加を通じて、医療従事者が認識し、適切か
つ適時に管理できるよう潜在的リスクを十分に伝達すること
が重要である。
回転性めまい:
2024年5月7日時点でAEMSデータベースにおいて「組み換
え水痘帯状疱疹ウイルス糖蛋白質E抗原」と反応語「回転性
めまい」を検索したところ、現地症例13例を発見し11例が単
一被疑症例であった。さらに、2024年5月7日にVigiBaseを
検索したところ、「水痘帯状疱疹ワクチン(AI)」と「回転性め
まい(PT)」を関連付ける701例が見つかり、611例が単一被
疑症例であった。701例のうち、437例が「シングリックス
(TN)」で陽性IC値0.1と報告されている。
オーストラリアの現行添付文書には、プラセボ群(0.8%)に比
べワクチン群(1.2%)でより高い浮動性めまいがあったという
臨床試験データが記載されている。回転性めまいは特定の
タイプの浮動性めまいであり、浮動性めまいの記載中には
十分に提示されていない。浮動性めまい例50%以上が回転
性めまいによるものである。臨床試験でみられた浮動性め
まい報告率の上昇は、本剤と回転性めまいとの関連の可能
性を示していると考えられる。
浮動性めまいも回転性めまいも、高齢者の重大身体障害の
原因となっている。最も頻繁に本剤を投与されている年齢
群(すなわち50歳以上の成人)も転倒などの事象のリスクが
高まっている。したがって、本剤接種後の回転性めまいの
潜在的リスクについて、臨床医と消費者に知らせることには
臨床的なメリットがある。
対応中
豪州添付文書のSpecial warnings and precautions for use
及びAdverse effectsの項に心血管死として、以下の内容が
追記された。
一部の観察研究で、アジスロマイシンに曝露された成人に
おいて、急性心血管死のリスクが、アモキシシリンを含む他
アジスロマイシン水 の抗菌薬に比べて約2倍増加することが示されている。観察 オーストラリ
245
その他
和物
研究のデータは、急性心血管死とアジスロマイシンの使用 ア
との因果関係の立証又は除外には不十分である。この潜在
的リスクは、アジスロマイシン使用開始後5日間に大きくなる
ことが指摘されている。QTc延長のリスクが高い患者では、
心電図検査の実施を考慮する。本剤を処方する際には、こ
の潜在的リスクと治療効果のバランスを考慮すること。
注目
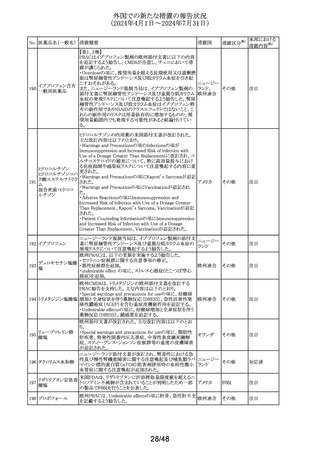
34/48
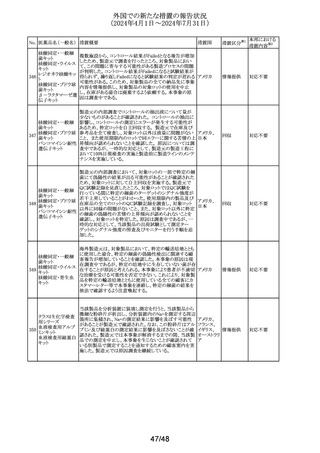
(2024年4月1日~2024年7月31日)
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
豪TGAは本剤の添付文書のAdverse Effectsの項にギラン・
バレー症候群(GBS)及び回転性めまいを含める更新を要
請した。 主な内容は以下の通り。
GBS:
2024年5月6日時点でTGAの有害事象管理システム
(AEMS)データベースにおいて「組み換え水痘帯状疱疹ウ
イルス糖蛋白質E抗原」と反応語「ギラン・バレー症候群」を
検索したところ、現地症例計5例のうち3例は単一被疑症例
であった。さらに、2024年5月6日にWHOのグローバル有害
事象データベースであるVigiBaseを検索したところ、「水痘
帯状疱疹ワクチン(AI)」と「ギラン・バレー症候群(PT)」を関
連付ける708例を発見し、549例が単一被疑症例、陽性
IC025値は2.4であった。708例のうち、509例が「シングリック
ス(TN)」で、陽性IC025値は3.3と報告されている。
オーストラリアの現行添付文書には、Special Warning and
Precautions for Useの項にGBSについて「65歳以上個人を
対象とした市販後観察研究において、本剤接種後42日間
にGBSリスク増加(投与100万回当たり推定3例余り)が観察
された。入手可能な情報は、本剤との因果関係を確定する
には不十分である」と記載されているが、Adverse Effectsの
項において予防接種後有害事象として言及していない。
米国及びカナダの添付文書には、Warnings and
Precautions、Adverse Reactions及び Postmarketing
Experienceの項に、本剤接種後のGBS潜在リスクに関する
市販後観察研究に関する段落があり、本剤接種後42日間
のGBSリスク上昇を強調している。
乾燥組換え帯状疱
市販後現地及び海外症例が報告されていること、並びに、
疹ワクチン(チャイ
オーストラリ
244
国際市販後観察研究において本剤接種後のGBS発現エビ
その他
ニーズハムスター卵
ア
デンスが報告されていることを踏まえ、Adverse Effectsの項
巣細胞由来)
への有害事象追加を通じて、医療従事者が認識し、適切か
つ適時に管理できるよう潜在的リスクを十分に伝達すること
が重要である。
回転性めまい:
2024年5月7日時点でAEMSデータベースにおいて「組み換
え水痘帯状疱疹ウイルス糖蛋白質E抗原」と反応語「回転性
めまい」を検索したところ、現地症例13例を発見し11例が単
一被疑症例であった。さらに、2024年5月7日にVigiBaseを
検索したところ、「水痘帯状疱疹ワクチン(AI)」と「回転性め
まい(PT)」を関連付ける701例が見つかり、611例が単一被
疑症例であった。701例のうち、437例が「シングリックス
(TN)」で陽性IC値0.1と報告されている。
オーストラリアの現行添付文書には、プラセボ群(0.8%)に比
べワクチン群(1.2%)でより高い浮動性めまいがあったという
臨床試験データが記載されている。回転性めまいは特定の
タイプの浮動性めまいであり、浮動性めまいの記載中には
十分に提示されていない。浮動性めまい例50%以上が回転
性めまいによるものである。臨床試験でみられた浮動性め
まい報告率の上昇は、本剤と回転性めまいとの関連の可能
性を示していると考えられる。
浮動性めまいも回転性めまいも、高齢者の重大身体障害の
原因となっている。最も頻繁に本剤を投与されている年齢
群(すなわち50歳以上の成人)も転倒などの事象のリスクが
高まっている。したがって、本剤接種後の回転性めまいの
潜在的リスクについて、臨床医と消費者に知らせることには
臨床的なメリットがある。
対応中
豪州添付文書のSpecial warnings and precautions for use
及びAdverse effectsの項に心血管死として、以下の内容が
追記された。
一部の観察研究で、アジスロマイシンに曝露された成人に
おいて、急性心血管死のリスクが、アモキシシリンを含む他
アジスロマイシン水 の抗菌薬に比べて約2倍増加することが示されている。観察 オーストラリ
245
その他
和物
研究のデータは、急性心血管死とアジスロマイシンの使用 ア
との因果関係の立証又は除外には不十分である。この潜在
的リスクは、アジスロマイシン使用開始後5日間に大きくなる
ことが指摘されている。QTc延長のリスクが高い患者では、
心電図検査の実施を考慮する。本剤を処方する際には、こ
の潜在的リスクと治療効果のバランスを考慮すること。
注目
34/48