よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
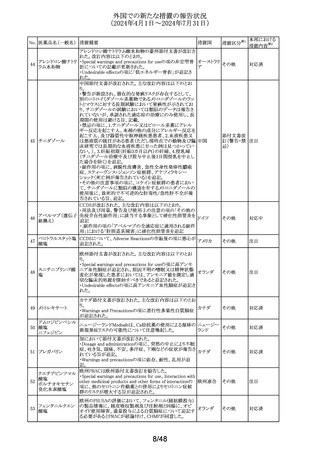
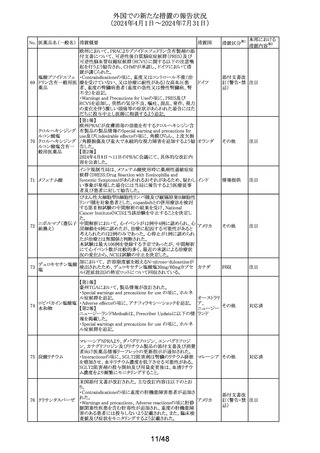
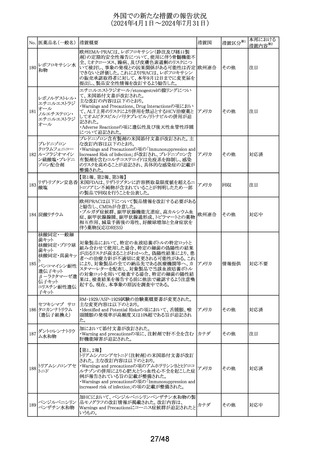
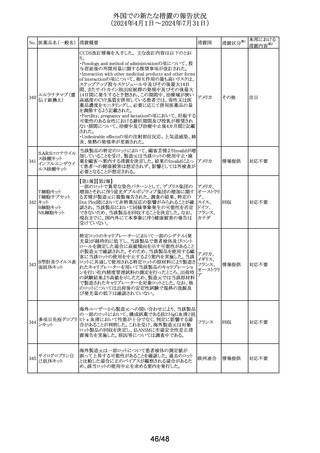
No. 医薬品名(一般名) 措置概要
措置国
Core Risk Management Planが改訂された。主な改訂内容
は以下のとおり。
・「硬化性胆管炎」、「関節炎」、「リウマチ性多発筋痛」、
「シェーグレン症候群」を「重要な特定されたリスク」に追加
・免疫チェックポイント阻害剤による治療後の免疫介在性副
作用のリスクが、自己免疫疾患を合併していない患者にお
けるリスクと比較して増加する可能性が示唆されたことから、
「不足情報」として設定されていた「自己免疫疾患の合併が
アベルマブ(遺伝子 ある患者における安全性」を「重要な特定されたリスク」に変
237
ドイツ
組換え)
更
・「不足情報」として設定されていた「長期投与」について、
臨床試験データ、市販後データ及び文献情報から、長期
投与した患者において新たな安全性の懸念がないことが示
されたことから、「不足情報」から削除された。
・「不足情報」として設定されていた 「臓器移植歴のある患
者における安全性」について、当該不足情報に対する追加
の医薬品安全性監視活動等がないことから、「不足情報」か
ら削除された。
238
本剤のClinical overviewの補遺として、アルバニア、モンテ
ニルマトレルビル・リ
ネグロ、セルビアにおいて免疫抑制剤との薬物相互に関す アメリカ
トナビル
るDHPCが発出された旨が追記された。
措置区分※1
本邦における
措置内容※2
その他
対応中
情報提供
注目
パロキセチン塩酸
239
塩水和物
ニュージーランドMedsafeは、過量投与と自殺の症例は多要
因であるが、アルコールとうつ病が主要な危険因子であると ニュージー
その他
し、SSRI又はSNRIとアルコールとの併用について注意喚起 ランド
を行った。
対応済
240 ケトプロフェン
豪州において、ケトプロフェン経口剤の添付文書が改訂さ
れた。改訂内容は以下のとおり。
・Special Warnings and Precautions for Useの項及び
Adverse Effects(Undesirable Effects)の項について、固定 オーストラリ
その他
薬疹が追記された。
ア
・Fertility, Pregnancy and Lactationの項について、妊娠後
期の女性では子宮収縮を抑制し分娩遅延を起こすおそれ
があるため投与しない旨の注意喚起が記載整備された。
注目
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Interaction with other medicinal products and other forms
of interactionの項において、CYP3A4及びBCRPの基質で
241 パルボシクリブ
あるスタチン系薬剤の併用により、スタチン系薬剤の血中濃 オランダ
その他
対応済
度が上昇し、横紋筋融解症のリスクが増加する可能性があ
る旨が記載された。
・Undesirable effectsの項に血中クレアチニン増加が記載さ
れた。
タイにおいて、イコサペント酸エチルの添付文書が改訂され
た。主な内容は以下のとおり。
添付文書改
イコサペント酸エチ ・Contraindications、Interaction with other medicinal
242
タイ
訂(警告・禁 対応済
ル
products and other forms of interactionsの項に、ミフェプリ
忌)
ストン・ミソプロストールとの併用は禁忌である旨を追記す
る。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precaution for use、Adverse effects
オーストラリ
243 ゲムシタビン塩酸塩 (Undesirable effects)の項にスティーヴンス・ジョンソン症候
その他
対応中
ア
群(SJS)、中毒性表皮壊死融解症(TEN)、急性全身性発
疹性膿疱症(AGEP)等の重篤な皮膚副作用が追記され
た。
33/48
(2024年4月1日~2024年7月31日)
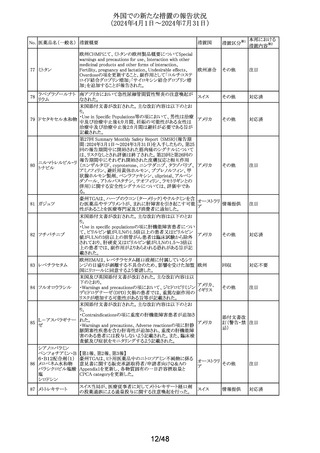
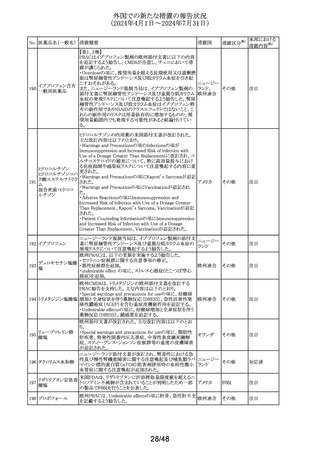
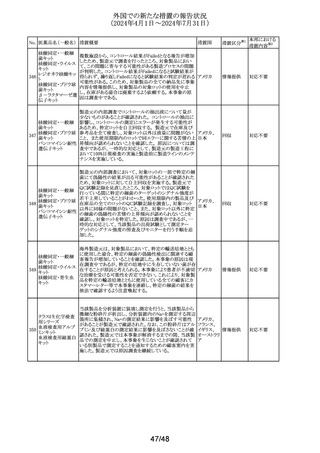
No. 医薬品名(一般名) 措置概要
措置国
Core Risk Management Planが改訂された。主な改訂内容
は以下のとおり。
・「硬化性胆管炎」、「関節炎」、「リウマチ性多発筋痛」、
「シェーグレン症候群」を「重要な特定されたリスク」に追加
・免疫チェックポイント阻害剤による治療後の免疫介在性副
作用のリスクが、自己免疫疾患を合併していない患者にお
けるリスクと比較して増加する可能性が示唆されたことから、
「不足情報」として設定されていた「自己免疫疾患の合併が
アベルマブ(遺伝子 ある患者における安全性」を「重要な特定されたリスク」に変
237
ドイツ
組換え)
更
・「不足情報」として設定されていた「長期投与」について、
臨床試験データ、市販後データ及び文献情報から、長期
投与した患者において新たな安全性の懸念がないことが示
されたことから、「不足情報」から削除された。
・「不足情報」として設定されていた 「臓器移植歴のある患
者における安全性」について、当該不足情報に対する追加
の医薬品安全性監視活動等がないことから、「不足情報」か
ら削除された。
238
本剤のClinical overviewの補遺として、アルバニア、モンテ
ニルマトレルビル・リ
ネグロ、セルビアにおいて免疫抑制剤との薬物相互に関す アメリカ
トナビル
るDHPCが発出された旨が追記された。
措置区分※1
本邦における
措置内容※2
その他
対応中
情報提供
注目
パロキセチン塩酸
239
塩水和物
ニュージーランドMedsafeは、過量投与と自殺の症例は多要
因であるが、アルコールとうつ病が主要な危険因子であると ニュージー
その他
し、SSRI又はSNRIとアルコールとの併用について注意喚起 ランド
を行った。
対応済
240 ケトプロフェン
豪州において、ケトプロフェン経口剤の添付文書が改訂さ
れた。改訂内容は以下のとおり。
・Special Warnings and Precautions for Useの項及び
Adverse Effects(Undesirable Effects)の項について、固定 オーストラリ
その他
薬疹が追記された。
ア
・Fertility, Pregnancy and Lactationの項について、妊娠後
期の女性では子宮収縮を抑制し分娩遅延を起こすおそれ
があるため投与しない旨の注意喚起が記載整備された。
注目
欧州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Interaction with other medicinal products and other forms
of interactionの項において、CYP3A4及びBCRPの基質で
241 パルボシクリブ
あるスタチン系薬剤の併用により、スタチン系薬剤の血中濃 オランダ
その他
対応済
度が上昇し、横紋筋融解症のリスクが増加する可能性があ
る旨が記載された。
・Undesirable effectsの項に血中クレアチニン増加が記載さ
れた。
タイにおいて、イコサペント酸エチルの添付文書が改訂され
た。主な内容は以下のとおり。
添付文書改
イコサペント酸エチ ・Contraindications、Interaction with other medicinal
242
タイ
訂(警告・禁 対応済
ル
products and other forms of interactionsの項に、ミフェプリ
忌)
ストン・ミソプロストールとの併用は禁忌である旨を追記す
る。
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Special warnings and precaution for use、Adverse effects
オーストラリ
243 ゲムシタビン塩酸塩 (Undesirable effects)の項にスティーヴンス・ジョンソン症候
その他
対応中
ア
群(SJS)、中毒性表皮壊死融解症(TEN)、急性全身性発
疹性膿疱症(AGEP)等の重篤な皮膚副作用が追記され
た。
33/48