よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
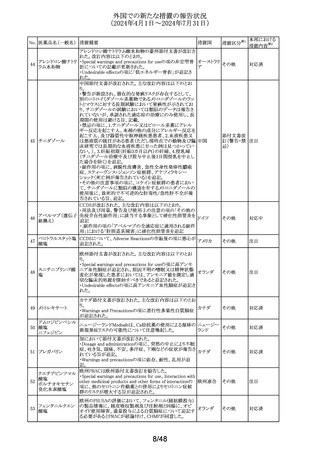
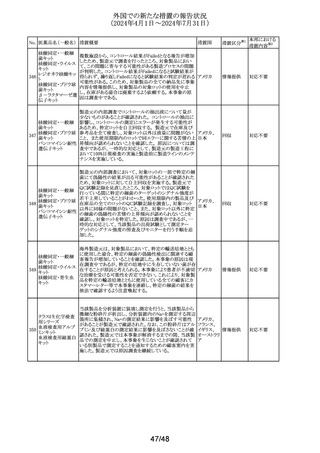
No. 医薬品名(一般名) 措置概要
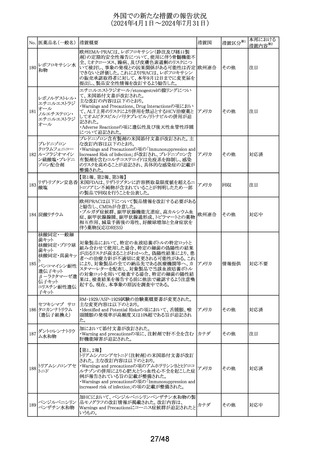
125 フェノフィブラート
措置国
フェノフィブラートの米国添付文書が改訂された。主な内容
は以下のとおり。
Contraindicationsの項
①本剤の賦形剤に対する過敏症、フェノフィブラートでアナ
フィラキシー及び血管浮腫を含む重篤な過敏反応が報告さ
れている旨を追記する。
Warnings and Precautionsの項
②死亡率及び冠動脈心疾患罹病率の項に、2型糖尿病患
者を対象とした2件の大規模ランダム化比較試験では、フェ
ノフィブラートは心血管疾患の罹病率及び死亡率を低下さ
せなかった旨を追記する。
③静脈塞栓性疾患の項に、ペマフィブラートを用いた心血
管系アウトカム試験における肺塞栓症、深部静脈血栓症の
発現率を追記する。
④筋障害及び横紋筋融解症の項に、筋障害(クレアチンキ
ナーゼ(CK)の上昇に伴う筋肉痛、圧痛、筋力低下)及び
横紋筋融解症を引き起こすことがあること、ミオパシーの危
険因子、ミオパシー及び横紋筋融解症のリスクを予防又は
軽減するための手順を追記する。
⑤胆石症の項に、本剤はすでに胆嚢疾患がある患者には
禁忌である旨を追記する。
⑥急性過敏症の項に、本剤はフェノフィブラート、フェノフィ
ブリン酸、又は本剤の成分に対して過敏症のある患者には
禁忌である旨を追記する。
Adverse Reactionsの項
⑦筋障害及び横紋筋融解症、血清クレアチニン値の上昇、
胆石症、クマリン系抗凝固薬による出血リスクの上昇、血液
アメリカ
学的変化を追記する。
⑧Clinical Trail Experienceの項に、高トリグリセリド血症又
は原発性高脂血症の成人患者を対象に、他のフェノフィブ
ラート製剤の十分かつ適切にコントロールされた試験に基
づいて、本剤の安全性が確立されている旨を追記する。
⑨Postmarketing Experienceの項に、免疫系疾患:アナフィ
ラキシー、血管性浮腫を追記する。
Use in Specific Populationsの項
⑩Pediatric Useの項に、本剤の安全性と有効性は、重度の
高トリグリセリド血症又は原発性高脂血症の小児患者では
確立されていない旨を追記する。
⑪Renal Impairmentの項に、末期腎疾患(ESRD)及び透析
を受けている患者を含む重度の腎機能障害患者(eGFR
<30mL/分)には禁忌である。軽度又は中等度の腎機能障
害(eGFR 30~60mL/分未満)を有する患者では、本剤の
使用は推奨されない。腎障害は筋障害及び横紋筋融解症
の危険因子である旨を追記する。
⑫Hepatic Impaiementの項に、説明のつかない持続性の肝
機能異常を有する患者を含む活動性肝疾患の患者には禁
忌である旨を追記する。
⑬Pregnancyの項をPLLRに従い記載整備し、潜在的な有
益性が胎児へのリスクを正当化する場合にのみ、妊娠中に
使用すべきである旨を記載する。
⑭Lactationの項をPLLRに従い記載整備し、授乳中の乳児
では、乳児の脂質代謝が阻害されるなどの重篤な副作用の
可能性があるため、本剤の投与期間中及び最終投与後5
日間は授乳を行わないことを記載する。
措置区分※1
添付文書改
訂(警告・禁 注目
忌)
パロキセチン塩酸
塩水和物
セルトラリン塩酸塩
エスシタロプラム
豪TGAにおいて、SSRI、SNRIの製品情報が改訂された。
シュウ酸塩
・Special warnings and precautions for useの項に性機能障 オーストラリ
126 ボルチオキセチン
その他
害が追記され、中止後も症状が持続する症例の報告もある ア
臭化水素酸塩
旨が記載。
フルボキサミンマレ
イン酸塩
デュロキセチン塩酸
塩
17/48
本邦における
措置内容※2
注目
(2024年4月1日~2024年7月31日)
No. 医薬品名(一般名) 措置概要
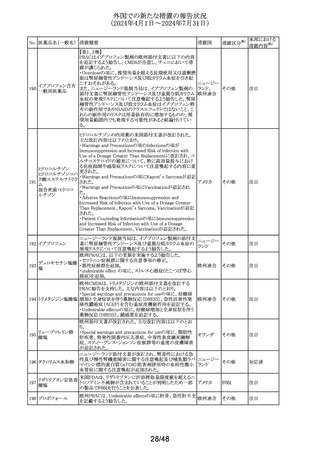
125 フェノフィブラート
措置国
フェノフィブラートの米国添付文書が改訂された。主な内容
は以下のとおり。
Contraindicationsの項
①本剤の賦形剤に対する過敏症、フェノフィブラートでアナ
フィラキシー及び血管浮腫を含む重篤な過敏反応が報告さ
れている旨を追記する。
Warnings and Precautionsの項
②死亡率及び冠動脈心疾患罹病率の項に、2型糖尿病患
者を対象とした2件の大規模ランダム化比較試験では、フェ
ノフィブラートは心血管疾患の罹病率及び死亡率を低下さ
せなかった旨を追記する。
③静脈塞栓性疾患の項に、ペマフィブラートを用いた心血
管系アウトカム試験における肺塞栓症、深部静脈血栓症の
発現率を追記する。
④筋障害及び横紋筋融解症の項に、筋障害(クレアチンキ
ナーゼ(CK)の上昇に伴う筋肉痛、圧痛、筋力低下)及び
横紋筋融解症を引き起こすことがあること、ミオパシーの危
険因子、ミオパシー及び横紋筋融解症のリスクを予防又は
軽減するための手順を追記する。
⑤胆石症の項に、本剤はすでに胆嚢疾患がある患者には
禁忌である旨を追記する。
⑥急性過敏症の項に、本剤はフェノフィブラート、フェノフィ
ブリン酸、又は本剤の成分に対して過敏症のある患者には
禁忌である旨を追記する。
Adverse Reactionsの項
⑦筋障害及び横紋筋融解症、血清クレアチニン値の上昇、
胆石症、クマリン系抗凝固薬による出血リスクの上昇、血液
アメリカ
学的変化を追記する。
⑧Clinical Trail Experienceの項に、高トリグリセリド血症又
は原発性高脂血症の成人患者を対象に、他のフェノフィブ
ラート製剤の十分かつ適切にコントロールされた試験に基
づいて、本剤の安全性が確立されている旨を追記する。
⑨Postmarketing Experienceの項に、免疫系疾患:アナフィ
ラキシー、血管性浮腫を追記する。
Use in Specific Populationsの項
⑩Pediatric Useの項に、本剤の安全性と有効性は、重度の
高トリグリセリド血症又は原発性高脂血症の小児患者では
確立されていない旨を追記する。
⑪Renal Impairmentの項に、末期腎疾患(ESRD)及び透析
を受けている患者を含む重度の腎機能障害患者(eGFR
<30mL/分)には禁忌である。軽度又は中等度の腎機能障
害(eGFR 30~60mL/分未満)を有する患者では、本剤の
使用は推奨されない。腎障害は筋障害及び横紋筋融解症
の危険因子である旨を追記する。
⑫Hepatic Impaiementの項に、説明のつかない持続性の肝
機能異常を有する患者を含む活動性肝疾患の患者には禁
忌である旨を追記する。
⑬Pregnancyの項をPLLRに従い記載整備し、潜在的な有
益性が胎児へのリスクを正当化する場合にのみ、妊娠中に
使用すべきである旨を記載する。
⑭Lactationの項をPLLRに従い記載整備し、授乳中の乳児
では、乳児の脂質代謝が阻害されるなどの重篤な副作用の
可能性があるため、本剤の投与期間中及び最終投与後5
日間は授乳を行わないことを記載する。
措置区分※1
添付文書改
訂(警告・禁 注目
忌)
パロキセチン塩酸
塩水和物
セルトラリン塩酸塩
エスシタロプラム
豪TGAにおいて、SSRI、SNRIの製品情報が改訂された。
シュウ酸塩
・Special warnings and precautions for useの項に性機能障 オーストラリ
126 ボルチオキセチン
その他
害が追記され、中止後も症状が持続する症例の報告もある ア
臭化水素酸塩
旨が記載。
フルボキサミンマレ
イン酸塩
デュロキセチン塩酸
塩
17/48
本邦における
措置内容※2
注目