よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1019KB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
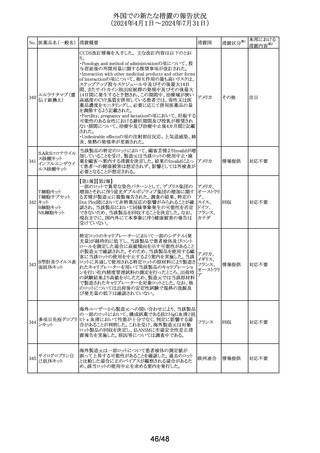
外国での新たな措置の報告状況
(2024年4月1日~2024年7月31日)
措置区分※1
本邦における
措置内容※2
カナグリフロジンのCCDSが改訂された。改訂内容は以下の
とおり。
・Warnings and precautionsの項の「Type 2 diabetes
カナグリフロジン水 mellitus」に、糖尿病性ケトアシドーシス(DKA)を伴う2型糖
和物
尿病患者について、腹部及び肥満外科手術を含む大手術
テネリグリプチン臭 又は長期の絶食に関連するその他の侵襲的手技を実施す
109 化水素酸塩水和
る場合は、可能であればその前に3日以上本剤の投与を中 アメリカ
物・カナグリフロジン 断する旨、DKAの初期の兆候及び症状をモニタリングする
水和物配合剤
ことが推奨される旨を追記する。
・Pregnancy, breast-feeding and fertilityの項に、ヒトの妊娠
第2期後期及び第3期に相当する幼若期ラットの腎臓の発
達期に本剤を投与したところ、腎臓への有害な影響が認め
られた旨を追記する。
その他
対応中
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
アメリカ
・Warnings and precautionsの項のSevere and fatal
immune-mediated adverse reactionsの記載に、その他の移
植(角膜移植を含む)拒絶反応が追加された。
その他
注目
その他
対応済
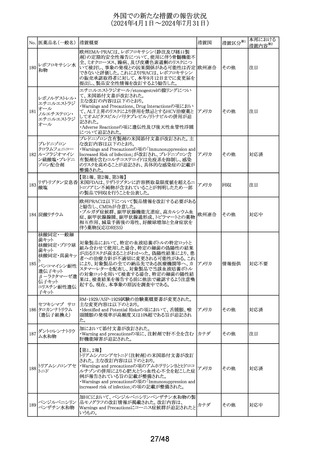
No. 医薬品名(一般名) 措置概要
110
アテゾリズマブ(遺
伝子組換え)
措置国
独BfArMは欧州における添付文書改訂の決定をうけ、フェ
ンタニル経粘膜性製剤の製品概要改訂を通知した。
フェンタニルクエン
・欧州のPSUSAの評価において、フェンタニル(経粘膜投
111 酸塩
ドイツ
与)の製品情報に、経皮吸収製剤及び注射剤と同様に、オ
フェンタニル
ピオイド使用障害、過量投与による白質脳症について追記
する必要があるとPRACが結論付け、CHMPが同意した。
非ピリン系感冒剤
(4)
112 プロメタジン塩酸塩
ヒベンズ酸プロメタ
ジン
ニュージーランドにおいてプロメタジン含有製剤の添付文
書が改訂された。改訂内容は以下のとおり。
・禁忌の項において、「2歳未満」から「6歳未満」の乳幼児
へ変更された。
添付文書改
ニュージー
訂(警告・禁 注目
ランド
忌)
米国添付文書が改訂された。
ヒドロキシジン塩酸
・Precautionsの項に、第一世代抗ヒスタミン薬の経口投与に
塩
より2歳未満の小児で中枢神経障害などの重篤な障害の報 アメリカ
113
ヒドロキシジンパモ
告があるため、6歳未満の小児には慎重に投与する旨が追
酸塩
記。
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に心不全、
心虚血等の心血管毒性が追加された。
・Undesirable effectsの項に心嚢液貯留、心膜炎、心不全
(心不全、急性心不全、慢性心不全、うっ血性心不全、心
114 ボスチニブ水和物
アメリカ
原性ショック、心腎症候群、駆出率低下、左心室不全を含
む)、心虚血性事象(急性冠症候群、急性心筋梗塞、狭心
症、不安定狭心症、冠動脈動脈硬化症、冠動脈疾患、冠
動脈閉塞、冠動脈狭窄、心筋梗塞、心筋虚血、トロポニン
増加を含む)が追加された。
欧州PRACは、欧州添付文書を改訂し、Special warnings
エタンブトール塩酸 and precautions for useの皮膚及び皮下組織の障害の項
欧州連合
115
に、好酸球増加と全身症状を伴う薬物反応(DRESS)を追記
塩
するよう勧告した。
オメプラゾール・アモキシシリン・リファブチン配合製剤の米
国添付文書が改訂され、Warnings and Precautionsの項
116 リファブチン
アメリカ
に、Drugs-Induced Enteroclitis Syndrome(DIES)が追記され
た。
加HCによる安全性レビューにより、3歳未満の小児に投与
した場合、甲状腺機能低下症の潜在的リスクがあり、低年
ヨード化ケシ油脂肪
117
齢、極低出生体重、早産児、心臓疾患、その他の疾患(集 カナダ
酸エチルエステル
中治療室への入院等)は甲状腺機能低下症の高いリスクと
関連があると結論づけられた。
【第1報】
米国FDAは、妊娠中肝内胆汁うっ滞の稀なリスクについて
医療従事者に注意喚起を行った。
【第2報】
118 アザチオプリン
アメリカ
米国添付文書が改訂され、妊婦の項に「妊娠中に妊娠性
肝内胆汁うっ滞が発現した場合には、本剤の投与を中止す
ること。」、副作用の項の製造販売後の使用経験の項に妊
娠中の肝内胆汁うっ滞が追記された。
15/48
その他
注目
その他
対応済
その他
注目
その他
対応不要
その他
注目
その他
注目
(2024年4月1日~2024年7月31日)
措置区分※1
本邦における
措置内容※2
カナグリフロジンのCCDSが改訂された。改訂内容は以下の
とおり。
・Warnings and precautionsの項の「Type 2 diabetes
カナグリフロジン水 mellitus」に、糖尿病性ケトアシドーシス(DKA)を伴う2型糖
和物
尿病患者について、腹部及び肥満外科手術を含む大手術
テネリグリプチン臭 又は長期の絶食に関連するその他の侵襲的手技を実施す
109 化水素酸塩水和
る場合は、可能であればその前に3日以上本剤の投与を中 アメリカ
物・カナグリフロジン 断する旨、DKAの初期の兆候及び症状をモニタリングする
水和物配合剤
ことが推奨される旨を追記する。
・Pregnancy, breast-feeding and fertilityの項に、ヒトの妊娠
第2期後期及び第3期に相当する幼若期ラットの腎臓の発
達期に本剤を投与したところ、腎臓への有害な影響が認め
られた旨を追記する。
その他
対応中
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
アメリカ
・Warnings and precautionsの項のSevere and fatal
immune-mediated adverse reactionsの記載に、その他の移
植(角膜移植を含む)拒絶反応が追加された。
その他
注目
その他
対応済
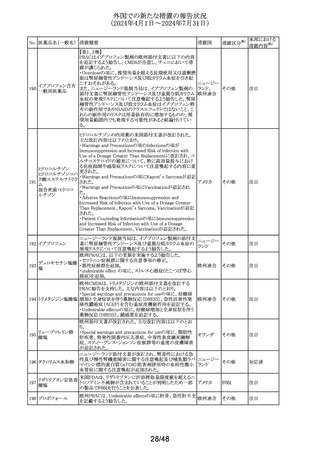
No. 医薬品名(一般名) 措置概要
110
アテゾリズマブ(遺
伝子組換え)
措置国
独BfArMは欧州における添付文書改訂の決定をうけ、フェ
ンタニル経粘膜性製剤の製品概要改訂を通知した。
フェンタニルクエン
・欧州のPSUSAの評価において、フェンタニル(経粘膜投
111 酸塩
ドイツ
与)の製品情報に、経皮吸収製剤及び注射剤と同様に、オ
フェンタニル
ピオイド使用障害、過量投与による白質脳症について追記
する必要があるとPRACが結論付け、CHMPが同意した。
非ピリン系感冒剤
(4)
112 プロメタジン塩酸塩
ヒベンズ酸プロメタ
ジン
ニュージーランドにおいてプロメタジン含有製剤の添付文
書が改訂された。改訂内容は以下のとおり。
・禁忌の項において、「2歳未満」から「6歳未満」の乳幼児
へ変更された。
添付文書改
ニュージー
訂(警告・禁 注目
ランド
忌)
米国添付文書が改訂された。
ヒドロキシジン塩酸
・Precautionsの項に、第一世代抗ヒスタミン薬の経口投与に
塩
より2歳未満の小児で中枢神経障害などの重篤な障害の報 アメリカ
113
ヒドロキシジンパモ
告があるため、6歳未満の小児には慎重に投与する旨が追
酸塩
記。
CCDSが改訂された。主な改訂内容は以下のとおり。
・Special warnings and precautions for useの項に心不全、
心虚血等の心血管毒性が追加された。
・Undesirable effectsの項に心嚢液貯留、心膜炎、心不全
(心不全、急性心不全、慢性心不全、うっ血性心不全、心
114 ボスチニブ水和物
アメリカ
原性ショック、心腎症候群、駆出率低下、左心室不全を含
む)、心虚血性事象(急性冠症候群、急性心筋梗塞、狭心
症、不安定狭心症、冠動脈動脈硬化症、冠動脈疾患、冠
動脈閉塞、冠動脈狭窄、心筋梗塞、心筋虚血、トロポニン
増加を含む)が追加された。
欧州PRACは、欧州添付文書を改訂し、Special warnings
エタンブトール塩酸 and precautions for useの皮膚及び皮下組織の障害の項
欧州連合
115
に、好酸球増加と全身症状を伴う薬物反応(DRESS)を追記
塩
するよう勧告した。
オメプラゾール・アモキシシリン・リファブチン配合製剤の米
国添付文書が改訂され、Warnings and Precautionsの項
116 リファブチン
アメリカ
に、Drugs-Induced Enteroclitis Syndrome(DIES)が追記され
た。
加HCによる安全性レビューにより、3歳未満の小児に投与
した場合、甲状腺機能低下症の潜在的リスクがあり、低年
ヨード化ケシ油脂肪
117
齢、極低出生体重、早産児、心臓疾患、その他の疾患(集 カナダ
酸エチルエステル
中治療室への入院等)は甲状腺機能低下症の高いリスクと
関連があると結論づけられた。
【第1報】
米国FDAは、妊娠中肝内胆汁うっ滞の稀なリスクについて
医療従事者に注意喚起を行った。
【第2報】
118 アザチオプリン
アメリカ
米国添付文書が改訂され、妊婦の項に「妊娠中に妊娠性
肝内胆汁うっ滞が発現した場合には、本剤の投与を中止す
ること。」、副作用の項の製造販売後の使用経験の項に妊
娠中の肝内胆汁うっ滞が追記された。
15/48
その他
注目
その他
対応済
その他
注目
その他
対応不要
その他
注目
その他
注目