よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.4MB] (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年8月1日~2024年11月30日)
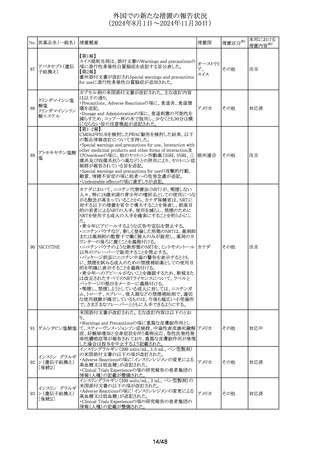
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
【第1報】
スウェーデンにおいて、不活化狂犬病ワクチンについて、容
器ゴム栓のコアリングによりワクチン溶液中に目視可能な粒
子が存在することが判明し、医療従事者向けのレターが発
出された。内容については以下のとおり。
1. 溶液に粒子が認められる報告があった。
2. 溶解後の本剤を注意深く目視確認し、粒子が認められる
場合は投与しないこと。
3. 溶解に関する推奨事項として、オレンジの針(25G)を使用
すること。
報告されたワクチン溶液内の目視可能な粒子を分析した結
果、バイアルのゴム栓のコアリングによるものと判明。本剤の
パックに含まれる針とゴム栓の組み合わせにより、コアリング スウェーデ
乾燥組織培養不活
140
イベントが増加する可能性がある。
ン、
情報提供
化狂犬病ワクチン
イギリス
【第2報】
英国MHRAと合意のもと、医療専門家向けレターが発出され
た。
本剤溶液中にコアリングによるゴム粒子混入があったこと、
ゴム粒子混入リスクを最小限に抑えるための推奨事項につ
いて。追加事項としては以下のとおり。
1.本剤の安全性と品質がこれらの推奨事項によって影響を
受けることはなく、目視検査で目に見える粒子がないことが
確認された後は、製品を安全に投与できることを強調。
2.本剤の現在の投与方法をさらに最適化するための措置を
講じているが、これらのステップには検査や当局承認が必
要となるため、追って通知があるまでレターの指示に従うこ
と。
ニュージーランドMedsafeと副作用モニタリングセンター
(CARM)は、医薬品による腱障害の症例報告103件のうち、
ニュージー
141 ゾレドロン酸水和物 疑われた上位4医薬品は、シプロフロキサシン(73件)、ノル
その他
ランド
フロキサシン(9件)、ゾレドロン酸(5件)、predonisone(3件)
であったことを公表した。
【第1, 2報】
テナパノル塩酸塩のCDSの以下の点が改訂された。
①Contraindicationsに機械的消化管閉塞の患者を追記
②Special Warnings and Precautions for Useに下痢に関す
142 テナパノル塩酸塩
アメリカ
その他
る発現状況および重度の下痢を発現した患者への処置を
追記
③Undesirable Effectsに過敏症:血管浮腫、アナフィラキ
シー、発疹(蕁麻疹を含む)を追記
ニュージーランドMedsafeにおいて製品情報が改訂され、
Special warnings and precautions for use及びUndesirable ニュージー
143 スルファジアジン銀
その他
effectsにスティーブンス・ジョンソン症候群 (SJS)、中毒性表 ランド
皮壊死融解症 (TEN)が追記された。
21/48
対応済
注目
注目
注目
(2024年8月1日~2024年11月30日)
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
本邦における
措置内容※2
【第1報】
スウェーデンにおいて、不活化狂犬病ワクチンについて、容
器ゴム栓のコアリングによりワクチン溶液中に目視可能な粒
子が存在することが判明し、医療従事者向けのレターが発
出された。内容については以下のとおり。
1. 溶液に粒子が認められる報告があった。
2. 溶解後の本剤を注意深く目視確認し、粒子が認められる
場合は投与しないこと。
3. 溶解に関する推奨事項として、オレンジの針(25G)を使用
すること。
報告されたワクチン溶液内の目視可能な粒子を分析した結
果、バイアルのゴム栓のコアリングによるものと判明。本剤の
パックに含まれる針とゴム栓の組み合わせにより、コアリング スウェーデ
乾燥組織培養不活
140
イベントが増加する可能性がある。
ン、
情報提供
化狂犬病ワクチン
イギリス
【第2報】
英国MHRAと合意のもと、医療専門家向けレターが発出され
た。
本剤溶液中にコアリングによるゴム粒子混入があったこと、
ゴム粒子混入リスクを最小限に抑えるための推奨事項につ
いて。追加事項としては以下のとおり。
1.本剤の安全性と品質がこれらの推奨事項によって影響を
受けることはなく、目視検査で目に見える粒子がないことが
確認された後は、製品を安全に投与できることを強調。
2.本剤の現在の投与方法をさらに最適化するための措置を
講じているが、これらのステップには検査や当局承認が必
要となるため、追って通知があるまでレターの指示に従うこ
と。
ニュージーランドMedsafeと副作用モニタリングセンター
(CARM)は、医薬品による腱障害の症例報告103件のうち、
ニュージー
141 ゾレドロン酸水和物 疑われた上位4医薬品は、シプロフロキサシン(73件)、ノル
その他
ランド
フロキサシン(9件)、ゾレドロン酸(5件)、predonisone(3件)
であったことを公表した。
【第1, 2報】
テナパノル塩酸塩のCDSの以下の点が改訂された。
①Contraindicationsに機械的消化管閉塞の患者を追記
②Special Warnings and Precautions for Useに下痢に関す
142 テナパノル塩酸塩
アメリカ
その他
る発現状況および重度の下痢を発現した患者への処置を
追記
③Undesirable Effectsに過敏症:血管浮腫、アナフィラキ
シー、発疹(蕁麻疹を含む)を追記
ニュージーランドMedsafeにおいて製品情報が改訂され、
Special warnings and precautions for use及びUndesirable ニュージー
143 スルファジアジン銀
その他
effectsにスティーブンス・ジョンソン症候群 (SJS)、中毒性表 ランド
皮壊死融解症 (TEN)が追記された。
21/48
対応済
注目
注目
注目