よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.4MB] (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年8月1日~2024年11月30日)
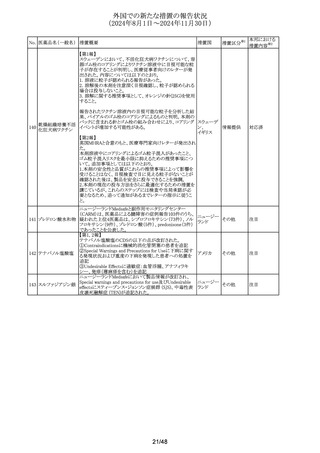
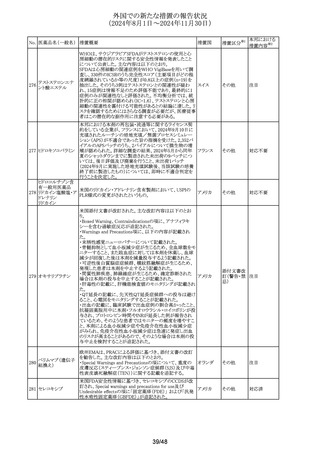
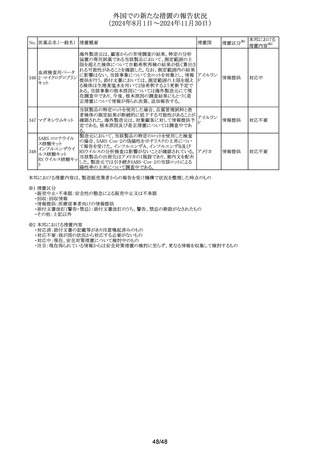
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州TGAは、プラバスタチンの添付文書を改訂した。主な
内容は以下のとおり。
①Special warnings and precautions for useの項に、以下を
追加。
1. HDLコレステロールの上昇による高コレステロール血症
には治療は適さない。
2.プラバスタチンとフィブラート系薬剤の併用は推奨されな
い。
3.ミオパシーおよび筋毒性リスク因子に関する内容の更新
4.クラリスロマイシンおよび他のマクロライド系薬剤との併用
においてミオパシーのリスクが増大する。
5.コルヒチンとの併用症例において、横紋筋融解症を含むミ
プラバスタチンナトリ
オーストラリ
292
オパシーが報告されている。
その他
ウム
ア
6.思春期前の小児では、治療開始前に医師が治療の有益
性と危険性を慎重に評価すべきである。
②Interactions with other medicines and other forms of
interactionsの項に、マクロライドを更新、レナリドミドを追加し
た。
③Fertility, pregnancy and lactationの項に、妊娠中の注意
を強化した。
④Adverse effectsの項に、めまい、頭痛、睡眠障害、重症筋
無力症、消化不良/胸やけ、腹痛、便秘、下痢、鼓張、発
疹、蕁麻疹、頭皮/毛髪異常、排尿異常、視力障害、眼筋
無力症、骨格筋への影響および肝臓への影響、皮膚及び
皮下組織障害を追加。
293 メトホルミン塩酸塩
294 フルオロウラシル
295 オキサリプラチン
豪の製造販売業者は、N-Nitrosodimethylamine(NDMA)が
オーストラリ
含まれているメトホルミン製剤と規格外になる可能性のある
回収
ア
製剤の回収を行った。
欧州添付文書の改訂が勧告された。主な改訂内容は以下
のとおり。
・Special Warnings and Precautions for useの項に、脳症(高
アンモニア血性脳症、白質脳症、可逆性後白質脳症症候
群、ウェルニッケ脳症)が報告されていること、高アンモニア
血性脳症は、乳酸アシドーシスと併発することがある旨を追
記
・Special Warnings and Precautions for useの項に、中等度 オランダ
その他
又は重度の腎機能障害を有するDPD欠損患者では、腎機
能障害により血中ウラシル濃度が上昇するため、血中のウラ
シル濃度を慎重に解釈する必要がある旨を追記
・Undesirable effectの項に、高トリグリセリド血症、ビタミンB1
欠乏症、ウェルニッケ脳症、腸炎、大腸炎(壊死性大腸炎を
含む)、血管外漏出による注射部位反応(疼痛、腫脹、発
赤)を追記
.豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
オーストラリ
・Fertility, Pregnancy and Lactationの項に、男性及び女性
その他
ア
の避妊期間、生殖能力への影響、授乳を避ける記載に
ウォッシュアウト期間を追記
デキサメタゾンリン酸エステルナトリウム注射液の豪州添付
文書のContraindicationsの項に、以下の患者への局所注射
は禁忌とされる旨が追記された。
添付文書改
オーストラリ
・菌血症
訂(警告・禁
ア
・不安定な関節
忌)
・注射部位の感染、例えば淋疾又は結核に起因する敗血症
性関節炎
296
デキサメタゾンプロ
ピオン酸エステル
297
チオトロピウム臭化物水和物の吸入用カプセルについて送
チオトロピウム臭化
達量均一性試験にて期待値を満たさなかったものがあった スイス
物水和物
ため、スイスにおいて特定ロットの予防的回収が行われる。
回収
ゾレドロン酸水和物の欧州添付文書が改訂され、
298 ゾレドロン酸水和物 Undesirable effectsの項に「尿細管間質性腎炎」が追記され イギリス
その他
た。
シルデナフィル(勃起不全の適応の製剤及び肺動脈性肺
高血圧症の適応の製剤)の豪州添付文書が改訂された。主
シルデナフィルクエ
オーストラリ
299
な内容は以下のとおり。
その他
ン酸塩
ア
・Special warnings and precautions for use、Undesirable
effectsの項に、中心性漿液性脈絡網膜症を追記する。
41/48
本邦における
措置内容※2
注目
対応不要
注目
対応済
対応不要
対応不要
対応済
注目
(2024年8月1日~2024年11月30日)
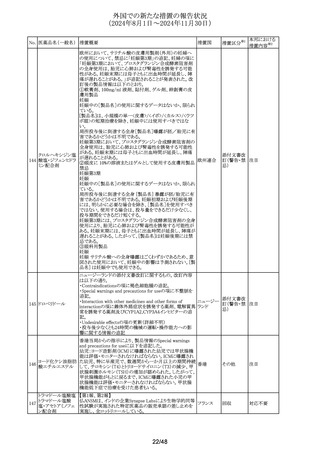
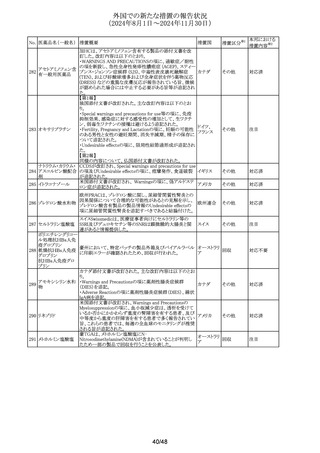
No. 医薬品名(一般名) 措置概要
措置国
措置区分※1
豪州TGAは、プラバスタチンの添付文書を改訂した。主な
内容は以下のとおり。
①Special warnings and precautions for useの項に、以下を
追加。
1. HDLコレステロールの上昇による高コレステロール血症
には治療は適さない。
2.プラバスタチンとフィブラート系薬剤の併用は推奨されな
い。
3.ミオパシーおよび筋毒性リスク因子に関する内容の更新
4.クラリスロマイシンおよび他のマクロライド系薬剤との併用
においてミオパシーのリスクが増大する。
5.コルヒチンとの併用症例において、横紋筋融解症を含むミ
プラバスタチンナトリ
オーストラリ
292
オパシーが報告されている。
その他
ウム
ア
6.思春期前の小児では、治療開始前に医師が治療の有益
性と危険性を慎重に評価すべきである。
②Interactions with other medicines and other forms of
interactionsの項に、マクロライドを更新、レナリドミドを追加し
た。
③Fertility, pregnancy and lactationの項に、妊娠中の注意
を強化した。
④Adverse effectsの項に、めまい、頭痛、睡眠障害、重症筋
無力症、消化不良/胸やけ、腹痛、便秘、下痢、鼓張、発
疹、蕁麻疹、頭皮/毛髪異常、排尿異常、視力障害、眼筋
無力症、骨格筋への影響および肝臓への影響、皮膚及び
皮下組織障害を追加。
293 メトホルミン塩酸塩
294 フルオロウラシル
295 オキサリプラチン
豪の製造販売業者は、N-Nitrosodimethylamine(NDMA)が
オーストラリ
含まれているメトホルミン製剤と規格外になる可能性のある
回収
ア
製剤の回収を行った。
欧州添付文書の改訂が勧告された。主な改訂内容は以下
のとおり。
・Special Warnings and Precautions for useの項に、脳症(高
アンモニア血性脳症、白質脳症、可逆性後白質脳症症候
群、ウェルニッケ脳症)が報告されていること、高アンモニア
血性脳症は、乳酸アシドーシスと併発することがある旨を追
記
・Special Warnings and Precautions for useの項に、中等度 オランダ
その他
又は重度の腎機能障害を有するDPD欠損患者では、腎機
能障害により血中ウラシル濃度が上昇するため、血中のウラ
シル濃度を慎重に解釈する必要がある旨を追記
・Undesirable effectの項に、高トリグリセリド血症、ビタミンB1
欠乏症、ウェルニッケ脳症、腸炎、大腸炎(壊死性大腸炎を
含む)、血管外漏出による注射部位反応(疼痛、腫脹、発
赤)を追記
.豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
オーストラリ
・Fertility, Pregnancy and Lactationの項に、男性及び女性
その他
ア
の避妊期間、生殖能力への影響、授乳を避ける記載に
ウォッシュアウト期間を追記
デキサメタゾンリン酸エステルナトリウム注射液の豪州添付
文書のContraindicationsの項に、以下の患者への局所注射
は禁忌とされる旨が追記された。
添付文書改
オーストラリ
・菌血症
訂(警告・禁
ア
・不安定な関節
忌)
・注射部位の感染、例えば淋疾又は結核に起因する敗血症
性関節炎
296
デキサメタゾンプロ
ピオン酸エステル
297
チオトロピウム臭化物水和物の吸入用カプセルについて送
チオトロピウム臭化
達量均一性試験にて期待値を満たさなかったものがあった スイス
物水和物
ため、スイスにおいて特定ロットの予防的回収が行われる。
回収
ゾレドロン酸水和物の欧州添付文書が改訂され、
298 ゾレドロン酸水和物 Undesirable effectsの項に「尿細管間質性腎炎」が追記され イギリス
その他
た。
シルデナフィル(勃起不全の適応の製剤及び肺動脈性肺
高血圧症の適応の製剤)の豪州添付文書が改訂された。主
シルデナフィルクエ
オーストラリ
299
な内容は以下のとおり。
その他
ン酸塩
ア
・Special warnings and precautions for use、Undesirable
effectsの項に、中心性漿液性脈絡網膜症を追記する。
41/48
本邦における
措置内容※2
注目
対応不要
注目
対応済
対応不要
対応不要
対応済
注目