よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.4MB] (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年8月1日~2024年11月30日)
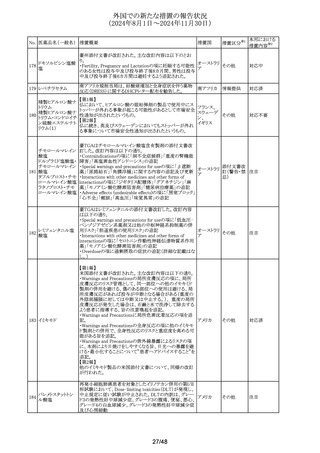
No. 医薬品名(一般名) 措置概要
223
豪州添付文書が改訂された。改訂内容は以下のとおり。
乾燥濃縮人血液凝
・Special warnings and precautions for useの項のインヒビ
固第8因子
ター発現に関する記載が改訂された。
措置国
オーストラリ
その他
ア
【第1報】
欧州EMAは5-FUを含有する薬剤について、DHPCレターの
配布を指示した。また、独BfArMも同内容のレターを発出し
た。
・中等度又は重度の腎機能障害を有する患者では、腎機能
障害により血中ウラシル濃度が上昇する可能性があるため、
テガフール・ギメラシ ジヒドロピリミジンデヒドロゲナーゼ(DPD)の表現型判定に使
ル・オテラシルカリウ 用される血中ウラシル濃度は慎重に解釈する必要がある。 ドイツ、
224 ム配合剤
・その結果、DPD欠損症の誤診リスクが高まり、5-FU の過少 フランス、
テガフール・ウラシ 投与につながり、治療効果が低下する可能性がある。
欧州連合
ル
【第2報】
上記の内容について、仏国仏ANSMが中等度又は重度の
腎機能障害では、DPD欠損の誤診による5-FUなどの過少
量投与リスクを回避するため、血清中ウラシル濃度の測定に
よるDPD表現型の判定を慎重に解釈する必要があること等
のレターを医療専門家に送付した。また同様の内容につい
て、欧州添付文書の改訂が指示された。
225 トラネキサム酸
措置区分※1
情報提供
(第1報)
ペルーにおいてトラネキサム酸注射剤の添付文書の以下の
項目が改訂されたことをブラジルの提携会社が報告した。
①Route of administrationの項に以下が追記された。
投与は、1分間に最大1mLの緩徐静脈内注射または点滴
(6.6節を参照)に厳密に限定される。
トラネキサム酸は静脈内投与のみとし、髄腔内投与または硬
膜外投与を行ってはならない(4.3項および4.4項参照)。
トラネキサム酸の誤った投与経路による致命的な投薬過誤
のリスクを軽減するため、トラネキサム酸を含むシリンジには
ラベルを貼付することが強く推奨される(セクション4.3、4.4、
および4.6を参照)。
②Warnings and special precautions for useの項に以下が
追加された。
血尿
上部尿路血尿の場合、下部尿路閉塞の危険性がある。
尿閉を放置すると、腎不全、尿路感染、水腎症、無尿などの
重篤な結果を招く可能性がある。したがって、上部尿路に血
尿がある患者または血尿のリスクがある患者には、綿密なモ
ニタリングが推奨される。
③Interaction with other drugs and other forms of
interactionの項に以下が追加された。
エストロゲンおよび/またはエストロゲンを含む複合ホルモン
避妊薬と併用すると、血栓形成の可能性が高まる理論的な
リスクがある。一方、本剤の抗線溶作用は血栓溶解薬によっ
て拮抗される可能性がある。
ブラジル、
④Fertility, pregnancy, and breastfeeding の項に以下が追
その他
南アフリカ
加された。
妊娠
妊娠第2期および第3期ならびに分娩時の妊婦におけるトラ
ネキサム酸の使用に関する公表された研究、症例シリーズ
および症例報告から入手可能なデータでは、本薬剤に関連
する流産または母体もしくは胎児の有害転帰のリスクがある
かどうかは明らかにされていない。妊娠中または妊娠第1期
の母体へのトラネキサム酸投与後に、新生児の死亡につな
がる胎児構造異常の症例がある。しかし、他の交絡因子の
ため、妊娠中のトラネキサム酸使用による重大な先天性異
常のリスクは明確に確立されていない。
母乳育児
母乳中にトラネキサム酸が存在することが文献で報告されて
いる。授乳中の児に対するトラネキサム酸の影響または乳汁
分泌への影響に関するデータは限られている。
生殖能
トラネキサム酸の生殖能力への影響に関する臨床データは
ない。動物実験では、トラネキサム酸は臨床的に適切な用
量で雄または雌の生殖能力に影響を与えなかった。
(第2報)
世界保健機関(WHO)のニュースレターにて、南アフリカ規
制当局(SAHPRA)は、トラネキサム酸注射剤の髄腔内への
投与過誤のリスクを最小化することを目的とし、トラネキサム
酸注射剤の製品ラベルについて、「HIGH ALERT」及び
「For IV Use Only」と記載する改訂を行ったことが公表され
た。
32/48
本邦における
措置内容※2
対応済
注目
対応済
(2024年8月1日~2024年11月30日)
No. 医薬品名(一般名) 措置概要
223
豪州添付文書が改訂された。改訂内容は以下のとおり。
乾燥濃縮人血液凝
・Special warnings and precautions for useの項のインヒビ
固第8因子
ター発現に関する記載が改訂された。
措置国
オーストラリ
その他
ア
【第1報】
欧州EMAは5-FUを含有する薬剤について、DHPCレターの
配布を指示した。また、独BfArMも同内容のレターを発出し
た。
・中等度又は重度の腎機能障害を有する患者では、腎機能
障害により血中ウラシル濃度が上昇する可能性があるため、
テガフール・ギメラシ ジヒドロピリミジンデヒドロゲナーゼ(DPD)の表現型判定に使
ル・オテラシルカリウ 用される血中ウラシル濃度は慎重に解釈する必要がある。 ドイツ、
224 ム配合剤
・その結果、DPD欠損症の誤診リスクが高まり、5-FU の過少 フランス、
テガフール・ウラシ 投与につながり、治療効果が低下する可能性がある。
欧州連合
ル
【第2報】
上記の内容について、仏国仏ANSMが中等度又は重度の
腎機能障害では、DPD欠損の誤診による5-FUなどの過少
量投与リスクを回避するため、血清中ウラシル濃度の測定に
よるDPD表現型の判定を慎重に解釈する必要があること等
のレターを医療専門家に送付した。また同様の内容につい
て、欧州添付文書の改訂が指示された。
225 トラネキサム酸
措置区分※1
情報提供
(第1報)
ペルーにおいてトラネキサム酸注射剤の添付文書の以下の
項目が改訂されたことをブラジルの提携会社が報告した。
①Route of administrationの項に以下が追記された。
投与は、1分間に最大1mLの緩徐静脈内注射または点滴
(6.6節を参照)に厳密に限定される。
トラネキサム酸は静脈内投与のみとし、髄腔内投与または硬
膜外投与を行ってはならない(4.3項および4.4項参照)。
トラネキサム酸の誤った投与経路による致命的な投薬過誤
のリスクを軽減するため、トラネキサム酸を含むシリンジには
ラベルを貼付することが強く推奨される(セクション4.3、4.4、
および4.6を参照)。
②Warnings and special precautions for useの項に以下が
追加された。
血尿
上部尿路血尿の場合、下部尿路閉塞の危険性がある。
尿閉を放置すると、腎不全、尿路感染、水腎症、無尿などの
重篤な結果を招く可能性がある。したがって、上部尿路に血
尿がある患者または血尿のリスクがある患者には、綿密なモ
ニタリングが推奨される。
③Interaction with other drugs and other forms of
interactionの項に以下が追加された。
エストロゲンおよび/またはエストロゲンを含む複合ホルモン
避妊薬と併用すると、血栓形成の可能性が高まる理論的な
リスクがある。一方、本剤の抗線溶作用は血栓溶解薬によっ
て拮抗される可能性がある。
ブラジル、
④Fertility, pregnancy, and breastfeeding の項に以下が追
その他
南アフリカ
加された。
妊娠
妊娠第2期および第3期ならびに分娩時の妊婦におけるトラ
ネキサム酸の使用に関する公表された研究、症例シリーズ
および症例報告から入手可能なデータでは、本薬剤に関連
する流産または母体もしくは胎児の有害転帰のリスクがある
かどうかは明らかにされていない。妊娠中または妊娠第1期
の母体へのトラネキサム酸投与後に、新生児の死亡につな
がる胎児構造異常の症例がある。しかし、他の交絡因子の
ため、妊娠中のトラネキサム酸使用による重大な先天性異
常のリスクは明確に確立されていない。
母乳育児
母乳中にトラネキサム酸が存在することが文献で報告されて
いる。授乳中の児に対するトラネキサム酸の影響または乳汁
分泌への影響に関するデータは限られている。
生殖能
トラネキサム酸の生殖能力への影響に関する臨床データは
ない。動物実験では、トラネキサム酸は臨床的に適切な用
量で雄または雌の生殖能力に影響を与えなかった。
(第2報)
世界保健機関(WHO)のニュースレターにて、南アフリカ規
制当局(SAHPRA)は、トラネキサム酸注射剤の髄腔内への
投与過誤のリスクを最小化することを目的とし、トラネキサム
酸注射剤の製品ラベルについて、「HIGH ALERT」及び
「For IV Use Only」と記載する改訂を行ったことが公表され
た。
32/48
本邦における
措置内容※2
対応済
注目
対応済