よむ、つかう、まなぶ。
資料2-3 外国での新たな措置の報告状況[1.4MB] (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_53729.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第3回 3/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
外国での新たな措置の報告状況
(2024年8月1日~2024年11月30日)
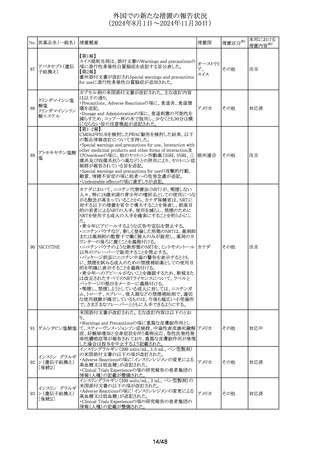
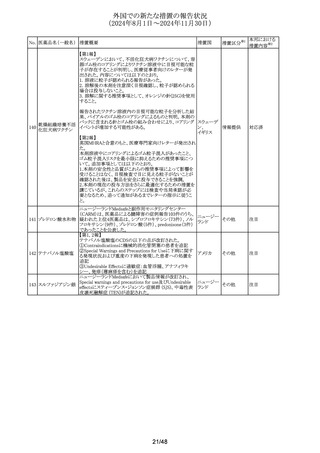
No. 医薬品名(一般名) 措置概要
措置国
韓国MFDSにて、ピタバスタチン含有製剤の添付文書の改
訂指示があった。主な内容は以下のとおり。
・以下の患者には投与しないことの項に、「重症筋無力症ま
たは眼筋無力症の患者(同一または異なるクラスのスタチン
ピタバスタチンカル
を投与した場合の再発が報告されている)」を追記
シウム
・副作用の項に、 「スタチンにおいて重症筋無力症または
259 ピタバスタチンカル
韓国
眼筋無力症の発症または悪化が報告されている。」を追記
シウム水和物・エゼ
・全般的な注意事項の項に、「稀にスタチンにより重症筋無
チミブ配合剤
力症または眼筋無力症が発症または悪化することがある。こ
れらの症状がある患者には慎重に投与すること。重症筋無
力症または眼筋無力症が発症または悪化した場合は投与
を中止すること。」を追記
措置区分※1
添付文書改
訂(警告・禁 注目
忌)
南アフリカ規制当局(SAHPRA)は、トラネキサム酸注射剤の
トラネキサム酸含有 髄腔内への投与過誤のリスクを最小化することを目的とし、ト
260
南アフリカ その他
一般用医薬品
ラネキサム酸注射剤の製品ラベルについて、「HIGH
ALERT」及び「For IV Use Only」と記載する改訂を行った。
インドメタシンナトリ
261 ウム水和物
インドメタシン
豪州TGAは、インドメタシン(適応:関節リウマチ、変形性関
節症等)の添付文書を改訂した。主な内容は以下のとおり。
①Interactions with other medicines and other forms of
interactionsの項に、金製剤は腎毒性を増加させる(腎臓で
オーストラリ
のプロスタグランジン合成阻害による)旨を追記
その他
ア
②Effects on ability to drive and use machinesの項に、治療
期間中は、自動車の運転や、注意力および迅速な精神運
動反応を必要とする他の活動に従事する際には注意が必
要である旨を追記
豪州添付文書が改訂された。改訂内容は以下のとおり。
ブデソニド・ホルモ
・Special warnings and precautions of useのPotential
オーストラリ
262 テロールフマル酸塩
その他
systemic effects of ICS(inhaled corticosteroid)の項に、クッ ア
水和物
シング症候群及びクッシング様症状が追加された。
豪州TGAがリバーロキサバンの添付文書の
オーストラリ
263 リバーロキサバン
AdverseEffects(UndesirableEffect)の項で脾臓破裂を追加し
その他
ア
たことを公表した。
英国MHRAは、経口懸濁液用の新しい胃耐性粉末及び溶
媒は,後発品を含む既存の経口懸濁液と互換性がなく、互
264 ポサコナゾール
イギリス
情報提供
換した場合重篤な副作用や薬効欠如のリスクがあるとし、医
療専門家向けのレターを発出した。
本剤のCORE DATA SHEET (CDS)の5.1.
Pharmacodynamic propertiesの項に、臨床試験におけるギ
ラン・バレー症候群及び過敏症の発現状況が追記された。
追加された内容は、以下のとおり。
265
組換えRSウイルス
ワクチン
266 タクロリムス水和物
5. PHARMACOLOGICAL PROPERTIES
5.1. Pharmacodynamic properties
アメリカ
その他
試験2では、本剤群の3例に重篤な有害事象が認められ、治
験薬との関連性があると判定され、2例にギラン・バレー症候
群の亜型(ワクチン接種7日後に報告された慢性特発性脱髄
性多発ニューロパチーおよびワクチン接種8日後に報告され
たフィッシャー症候群)1例にワクチン接種8時間後に報告さ
れた過敏症が認められた。
アイルランドの添付文書のFertility、 pregnancy and
lactationの項に非介入型承認後安全性試験
(EUPAS37025)の結果(タクロリムス群では他の免疫抑制薬
アイルラン
群に比べて自然流産の割合が高かった。また、腎移植患者
その他
ド
では子癇前症の割合が高い傾向にあった。しかしながら、こ
れらのリスクの有無を結論づけるには情報が不足している)
が追記された。
プソイドエフェドリン
ベルギーにおいて、法改正によりエフェドリン類含有製剤の
267 塩酸塩含有一般用
ベルギー その他
調剤区分が「処方箋医薬品」に変更されることとなった。
医薬品
豪州添付文書が改訂され、Interactions with other
ホスフルコナゾール
オーストラリ
268
medicines and other forms of interactionsの項に、アブロシ
その他
フルコナゾール
ア
チニブが追記された。
269 ミトタン
ミトタンの米国添付文書のAdverse Reactionsの項のClinical
アメリカ
Trials Experienceの項に呼吸困難、QT延長が追記された。
37/48
本邦における
措置内容※2
その他
対応不要
注目
注目
注目
対応不要
注目
注目
注目
対応済
注目
(2024年8月1日~2024年11月30日)
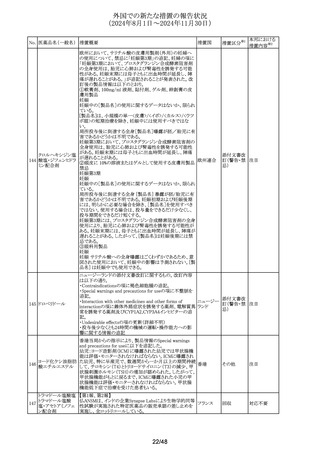
No. 医薬品名(一般名) 措置概要
措置国
韓国MFDSにて、ピタバスタチン含有製剤の添付文書の改
訂指示があった。主な内容は以下のとおり。
・以下の患者には投与しないことの項に、「重症筋無力症ま
たは眼筋無力症の患者(同一または異なるクラスのスタチン
ピタバスタチンカル
を投与した場合の再発が報告されている)」を追記
シウム
・副作用の項に、 「スタチンにおいて重症筋無力症または
259 ピタバスタチンカル
韓国
眼筋無力症の発症または悪化が報告されている。」を追記
シウム水和物・エゼ
・全般的な注意事項の項に、「稀にスタチンにより重症筋無
チミブ配合剤
力症または眼筋無力症が発症または悪化することがある。こ
れらの症状がある患者には慎重に投与すること。重症筋無
力症または眼筋無力症が発症または悪化した場合は投与
を中止すること。」を追記
措置区分※1
添付文書改
訂(警告・禁 注目
忌)
南アフリカ規制当局(SAHPRA)は、トラネキサム酸注射剤の
トラネキサム酸含有 髄腔内への投与過誤のリスクを最小化することを目的とし、ト
260
南アフリカ その他
一般用医薬品
ラネキサム酸注射剤の製品ラベルについて、「HIGH
ALERT」及び「For IV Use Only」と記載する改訂を行った。
インドメタシンナトリ
261 ウム水和物
インドメタシン
豪州TGAは、インドメタシン(適応:関節リウマチ、変形性関
節症等)の添付文書を改訂した。主な内容は以下のとおり。
①Interactions with other medicines and other forms of
interactionsの項に、金製剤は腎毒性を増加させる(腎臓で
オーストラリ
のプロスタグランジン合成阻害による)旨を追記
その他
ア
②Effects on ability to drive and use machinesの項に、治療
期間中は、自動車の運転や、注意力および迅速な精神運
動反応を必要とする他の活動に従事する際には注意が必
要である旨を追記
豪州添付文書が改訂された。改訂内容は以下のとおり。
ブデソニド・ホルモ
・Special warnings and precautions of useのPotential
オーストラリ
262 テロールフマル酸塩
その他
systemic effects of ICS(inhaled corticosteroid)の項に、クッ ア
水和物
シング症候群及びクッシング様症状が追加された。
豪州TGAがリバーロキサバンの添付文書の
オーストラリ
263 リバーロキサバン
AdverseEffects(UndesirableEffect)の項で脾臓破裂を追加し
その他
ア
たことを公表した。
英国MHRAは、経口懸濁液用の新しい胃耐性粉末及び溶
媒は,後発品を含む既存の経口懸濁液と互換性がなく、互
264 ポサコナゾール
イギリス
情報提供
換した場合重篤な副作用や薬効欠如のリスクがあるとし、医
療専門家向けのレターを発出した。
本剤のCORE DATA SHEET (CDS)の5.1.
Pharmacodynamic propertiesの項に、臨床試験におけるギ
ラン・バレー症候群及び過敏症の発現状況が追記された。
追加された内容は、以下のとおり。
265
組換えRSウイルス
ワクチン
266 タクロリムス水和物
5. PHARMACOLOGICAL PROPERTIES
5.1. Pharmacodynamic properties
アメリカ
その他
試験2では、本剤群の3例に重篤な有害事象が認められ、治
験薬との関連性があると判定され、2例にギラン・バレー症候
群の亜型(ワクチン接種7日後に報告された慢性特発性脱髄
性多発ニューロパチーおよびワクチン接種8日後に報告され
たフィッシャー症候群)1例にワクチン接種8時間後に報告さ
れた過敏症が認められた。
アイルランドの添付文書のFertility、 pregnancy and
lactationの項に非介入型承認後安全性試験
(EUPAS37025)の結果(タクロリムス群では他の免疫抑制薬
アイルラン
群に比べて自然流産の割合が高かった。また、腎移植患者
その他
ド
では子癇前症の割合が高い傾向にあった。しかしながら、こ
れらのリスクの有無を結論づけるには情報が不足している)
が追記された。
プソイドエフェドリン
ベルギーにおいて、法改正によりエフェドリン類含有製剤の
267 塩酸塩含有一般用
ベルギー その他
調剤区分が「処方箋医薬品」に変更されることとなった。
医薬品
豪州添付文書が改訂され、Interactions with other
ホスフルコナゾール
オーストラリ
268
medicines and other forms of interactionsの項に、アブロシ
その他
フルコナゾール
ア
チニブが追記された。
269 ミトタン
ミトタンの米国添付文書のAdverse Reactionsの項のClinical
アメリカ
Trials Experienceの項に呼吸困難、QT延長が追記された。
37/48
本邦における
措置内容※2
その他
対応不要
注目
注目
注目
対応不要
注目
注目
注目
対応済
注目