よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
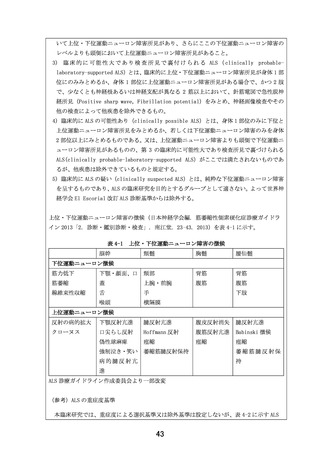
別紙1
患者申出療養 実施計画等評価表
評価者
主担当: 寺田 智祐
副担当: 井上 悠輔、新谷 歩
技術専門員: 辻 省次
申出に係る
筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研究
療養の名称
臨床研究中核
大阪大学医学部附属病院
病院の名称
実施医療機関
の名称
大阪大学医学部附属病院
(概要)
筋萎縮性側索硬化症(ALS)は未だ治療法が確立されていない難治性神経変性疾患
で、現状承認されている薬剤はわずか 2 種類でより生存期間を延長する、または臨
床症状を改善する、または使いやすい薬剤の開発が期待されている。本研究は、患
者申出療養制度に基づいて、先行する医師主導治験(DA350103)において使用され
た ALS に対して一定の効果が期待される EPI-589 を、DA350103 に参加した ALS 患者
に対して再投与した際の安全性と忍容性を確認する前向き介入試験である。
(効果)
医 療 技 術 先行する医師主導治験(DA350103)において、全被験者(いずれも EPI-589 実薬投
の
概
要 与)での結果は現在解析中であるが、今回本臨床研究への参加を希望している 1 名
の患者での ALSFRS-R スコア(12 項目、各項目 4 点満点の計 48 点満点、重症化に従
い減点)の合計点は、平均で被験薬投与中 0 点/月、投与終了後 1.25 点/月の減点
となっている。また当院で参加したもう 1 名の経過は、被験薬投与中 1 点/月、投
与終了後 2.25 点/月の減点となっている。両患者とも自覚的な日常生活動作の変化
についても、治験終了後に明らかにその増悪速度は速くなっていると述べている。
(患者申出療養に係る費用)
本臨床研究に係る総費用は 1,249,318 円である。そのうち、患者申出療養に係る費
用は 1,192,618 円である。
1
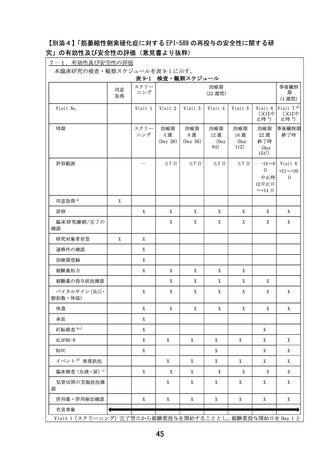
患者申出療養 実施計画等評価表
評価者
主担当: 寺田 智祐
副担当: 井上 悠輔、新谷 歩
技術専門員: 辻 省次
申出に係る
筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研究
療養の名称
臨床研究中核
大阪大学医学部附属病院
病院の名称
実施医療機関
の名称
大阪大学医学部附属病院
(概要)
筋萎縮性側索硬化症(ALS)は未だ治療法が確立されていない難治性神経変性疾患
で、現状承認されている薬剤はわずか 2 種類でより生存期間を延長する、または臨
床症状を改善する、または使いやすい薬剤の開発が期待されている。本研究は、患
者申出療養制度に基づいて、先行する医師主導治験(DA350103)において使用され
た ALS に対して一定の効果が期待される EPI-589 を、DA350103 に参加した ALS 患者
に対して再投与した際の安全性と忍容性を確認する前向き介入試験である。
(効果)
医 療 技 術 先行する医師主導治験(DA350103)において、全被験者(いずれも EPI-589 実薬投
の
概
要 与)での結果は現在解析中であるが、今回本臨床研究への参加を希望している 1 名
の患者での ALSFRS-R スコア(12 項目、各項目 4 点満点の計 48 点満点、重症化に従
い減点)の合計点は、平均で被験薬投与中 0 点/月、投与終了後 1.25 点/月の減点
となっている。また当院で参加したもう 1 名の経過は、被験薬投与中 1 点/月、投
与終了後 2.25 点/月の減点となっている。両患者とも自覚的な日常生活動作の変化
についても、治験終了後に明らかにその増悪速度は速くなっていると述べている。
(患者申出療養に係る費用)
本臨床研究に係る総費用は 1,249,318 円である。そのうち、患者申出療養に係る費
用は 1,192,618 円である。
1