よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (38 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
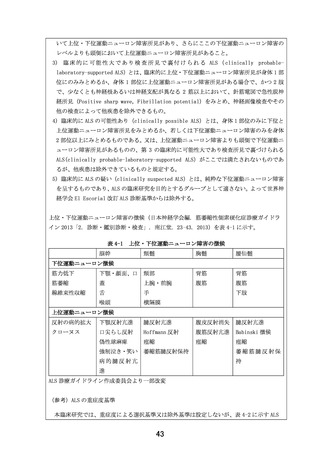
薬事承認までのロードマップ
日本に
おける
薬事承
認状況
海外第II相治験
国内第II相医師主導治験
企業治験
未承認
対象:筋萎縮性側索硬化症患者
デザイン:非盲検単群試験、
1000mg/日、3ヶ月
登録症例数:19例
試験期間:2016年1月~2018年2月
評価項目:有効性、安全性
対象:筋萎縮性側索硬化症患者
デザイン:非盲検単群試験、
1500mg/日、24週
登録症例数:10例
試験期間:2021年9月~2023年10月
評価項目:有効性、安全性
対象:筋萎縮性側索硬化症患者
デザイン:二重盲検試験、
投与量、投与期間は検討中
登録症例数:検討中
試験期間:検討中
評価項目:有効性、安全性
米国・
欧州に
おける
薬事承
認状況
未承認
2023年1月現在
EPI-589の筋萎縮性側索硬化症を
対象とした探索的試験
(EPI589-15-001試験)
EPI-589経口投与療法
れた患者に限る。)
EPI-589の筋萎縮性側索硬化症を
対象とした探索的試験
(DA350103試験)
【患者申出療養】
筋萎縮性側索硬化症(過去にEPI-589を投与さ
対象:DA350103試験を受け安全性、忍容性に問題のない筋萎縮性側索硬化症患者
目的:EPI-589の再投与の安全性及び忍容性を評価
デザイン:非盲検単群介入研究、1500mg/日、22週
登録症例数見込み:3例
予定期間:jRCT公表日~2024年12月
評価項目:安全性、改訂版ALS機能評価スケールによる有効性
実施医療機関:大阪大学医学部附属病院
安全性上の問題等で、継続が不適切と
考えられた場合
患者申出療養の取り下げ
38
EPI-589の筋萎縮性側索硬化症を
対象とした第II相試験(予定)、
第III相試験(予定)
参考
データ
有用性が認め
られた場合
承認申請
医療としての
有用性が認め
られなかった
場合
開発中止
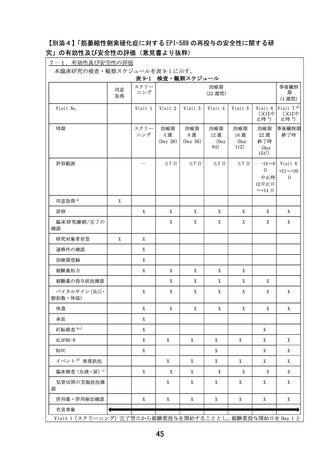
日本に
おける
薬事承
認状況
海外第II相治験
国内第II相医師主導治験
企業治験
未承認
対象:筋萎縮性側索硬化症患者
デザイン:非盲検単群試験、
1000mg/日、3ヶ月
登録症例数:19例
試験期間:2016年1月~2018年2月
評価項目:有効性、安全性
対象:筋萎縮性側索硬化症患者
デザイン:非盲検単群試験、
1500mg/日、24週
登録症例数:10例
試験期間:2021年9月~2023年10月
評価項目:有効性、安全性
対象:筋萎縮性側索硬化症患者
デザイン:二重盲検試験、
投与量、投与期間は検討中
登録症例数:検討中
試験期間:検討中
評価項目:有効性、安全性
米国・
欧州に
おける
薬事承
認状況
未承認
2023年1月現在
EPI-589の筋萎縮性側索硬化症を
対象とした探索的試験
(EPI589-15-001試験)
EPI-589経口投与療法
れた患者に限る。)
EPI-589の筋萎縮性側索硬化症を
対象とした探索的試験
(DA350103試験)
【患者申出療養】
筋萎縮性側索硬化症(過去にEPI-589を投与さ
対象:DA350103試験を受け安全性、忍容性に問題のない筋萎縮性側索硬化症患者
目的:EPI-589の再投与の安全性及び忍容性を評価
デザイン:非盲検単群介入研究、1500mg/日、22週
登録症例数見込み:3例
予定期間:jRCT公表日~2024年12月
評価項目:安全性、改訂版ALS機能評価スケールによる有効性
実施医療機関:大阪大学医学部附属病院
安全性上の問題等で、継続が不適切と
考えられた場合
患者申出療養の取り下げ
38
EPI-589の筋萎縮性側索硬化症を
対象とした第II相試験(予定)、
第III相試験(予定)
参考
データ
有用性が認め
られた場合
承認申請
医療としての
有用性が認め
られなかった
場合
開発中止