よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
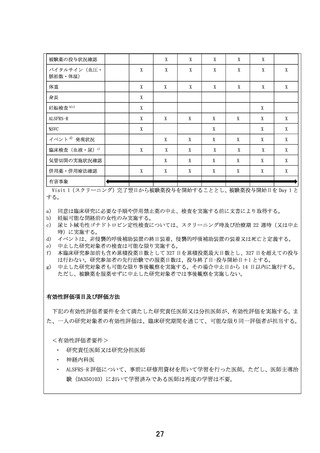
起こりうる有害事象
前治験はデータ固定前ですが、10 例が治療期に移行し、全症例治験のフォローが完了しているた
め、症例報告書から抽出した上記 10 例分の有害事象リスト(最終化前のもの)を確認しました。
結果、重篤な有害事象、重度の有害事象の発現は認められませんでした。中等度の有害事象とし
ては、不眠が 2 件、便秘が 2 件、頻尿が 1 件、筋痛が 1 件、関節痛が 1 件、COVID-19 感染が 1 件
認められましたが、いずれも非重篤でした。
また臨床では現時点で問題となっていませんが、上述のサル 39 週間毒性試験にて最高用量の
500mg/kg/day 群にて投与早期に状態悪化が認められ、原因として EPI-589 の骨格筋への影響が考
えられたため、本試験では、Visit ごとにクレアチンキナーゼ(CK)を測定し、骨格筋への影響を
迅速に検出できるよう配慮しています。
実施体制
本試験は臨床研究法下で行われる臨床研究(特定臨床研究)の枠組みで行われますが、前治験の
治験責任医師が研究責任医師を務め、経験のあるスタディマネージャー、統計家、CRC、データマ
ネージャー、モニター、監査担当者と品質マネジメントシステム体制を構築しています。
以上の観点から、本試験における EPI-589 を長期に投与することの安全性は十分確保されている
と考えられます。
有効性について
前治験の有効性に関し、全被験者(いずれも EPI-589 実薬投与)での結果は現在解析中ですが、
今回本試験への参加を希望している 1 名の患者での改訂版 ALS 機能評価スケール(12 項目、各項
目 4 点満点の計 48 点満点、重症化に従い減点)の合計点は、平均で被験薬投与中 0 点/月、投与
終了後 1.25 点/月の減点となっています。また当院で参加したもう 1 名の経過は、被験薬投与中
1 点/月、投与終了後 2.25 点/月の減点となっています。両患者とも自覚的な日常生活動作の変化
についても、治験終了後に明らかにその増悪速度は速くなっていると述べています。これらの結
果から本被験薬が有効である可能性があり、本試験においてさらなる投与を行うことは、長期投
与(wash-out 期間を挟む)でも上記結果が確認可能かなど、有効性に関しても一定の知見が得ら
れる可能性があります。
以上により、ALS という疾患の重篤性を考慮し、安全性と忍容性を検討し、ALSFRS-R スコア変化
量を測定する本試験を行う意義は十分にあると考えた次第です。
以上
11
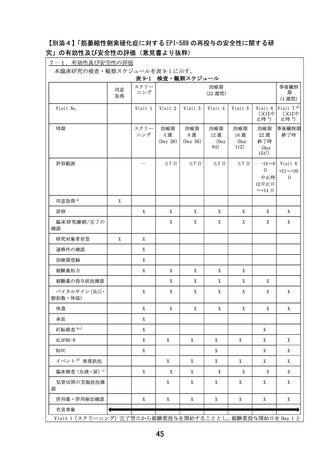
前治験はデータ固定前ですが、10 例が治療期に移行し、全症例治験のフォローが完了しているた
め、症例報告書から抽出した上記 10 例分の有害事象リスト(最終化前のもの)を確認しました。
結果、重篤な有害事象、重度の有害事象の発現は認められませんでした。中等度の有害事象とし
ては、不眠が 2 件、便秘が 2 件、頻尿が 1 件、筋痛が 1 件、関節痛が 1 件、COVID-19 感染が 1 件
認められましたが、いずれも非重篤でした。
また臨床では現時点で問題となっていませんが、上述のサル 39 週間毒性試験にて最高用量の
500mg/kg/day 群にて投与早期に状態悪化が認められ、原因として EPI-589 の骨格筋への影響が考
えられたため、本試験では、Visit ごとにクレアチンキナーゼ(CK)を測定し、骨格筋への影響を
迅速に検出できるよう配慮しています。
実施体制
本試験は臨床研究法下で行われる臨床研究(特定臨床研究)の枠組みで行われますが、前治験の
治験責任医師が研究責任医師を務め、経験のあるスタディマネージャー、統計家、CRC、データマ
ネージャー、モニター、監査担当者と品質マネジメントシステム体制を構築しています。
以上の観点から、本試験における EPI-589 を長期に投与することの安全性は十分確保されている
と考えられます。
有効性について
前治験の有効性に関し、全被験者(いずれも EPI-589 実薬投与)での結果は現在解析中ですが、
今回本試験への参加を希望している 1 名の患者での改訂版 ALS 機能評価スケール(12 項目、各項
目 4 点満点の計 48 点満点、重症化に従い減点)の合計点は、平均で被験薬投与中 0 点/月、投与
終了後 1.25 点/月の減点となっています。また当院で参加したもう 1 名の経過は、被験薬投与中
1 点/月、投与終了後 2.25 点/月の減点となっています。両患者とも自覚的な日常生活動作の変化
についても、治験終了後に明らかにその増悪速度は速くなっていると述べています。これらの結
果から本被験薬が有効である可能性があり、本試験においてさらなる投与を行うことは、長期投
与(wash-out 期間を挟む)でも上記結果が確認可能かなど、有効性に関しても一定の知見が得ら
れる可能性があります。
以上により、ALS という疾患の重篤性を考慮し、安全性と忍容性を検討し、ALSFRS-R スコア変化
量を測定する本試験を行う意義は十分にあると考えた次第です。
以上
11