よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
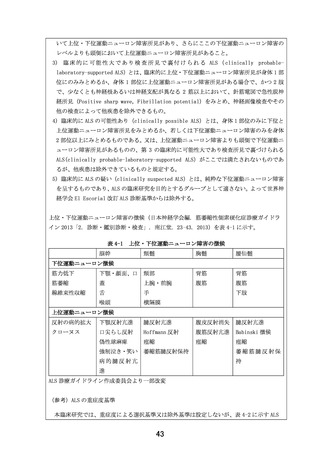
5.患者の適格基準及び選定方法
大阪大学医学部附属病院において、患者申出療養制度に基づき、スクリーニング時に、以下の選択
基準を全て満たし、かつ除外基準に抵触する項目がない症例を適格症例とする。
選択基準:下記の基準を全て満たした患者を対象とする。
1) 本臨床研究への参加について、本人より文書同意が得られた患者(同意能力はあるものの身
体が不自由なため、同意文書への自筆による署名ができない場合、代筆者による署名が得ら
れた患者)
2) 医師主導治験(DA350103)にエントリーされ、約 24 週間 EPI-589 の投与を受けたことがあ
り、安全性及び忍容性に問題がなかった患者
3) 外来通院が可能な患者
【選択基準の設定根拠】
1) 適切な同意が得られた研究対象者で研究を実施するために設定した。
2) 本臨床研究の目的は、EPI-589 を再投与したときの安全性及び忍容性を検討することである。
EPI-589 を再投与した実績がないため、医師主導治験で EPI-589 500 mg(EPI-589 250mg 錠 2
錠)を 1 日 3 回 24 週間投与した際の安全性及び忍容性に問題がなかった ALS 患者を対象に再
投与における安全性及び忍容性を検討することとした。
3) 本臨床研究では外来通院する必要があるため、設定した。
除外基準:下記の基準に一つでも当てはまる患者は対象としない。
1) 臨床的に意義のある重度の ALS 以外の合併症、既往症を有し、研究責任医師又は研究分担医
師が臨床研究の対象には不適切であると判断した患者
2) 精神疾患、認知機能障害、パーキンソン病を合併している患者
3) 気管切開を施行している患者
4) 非侵襲的呼吸補助装置の終日装着(22 時間以上の装着)をしている患者
5) 薬物アレルギー又は重度のアレルギー疾患(アナフィラキシーショック等)を既往又は合併
している患者
6) 悪性腫瘍を合併している、又は同意取得前 5 年以内に既往歴を有する患者
7) スクリーニング時において、AST、ALT が基準値上限の 3 倍以上の高値を示した患者
8) スクリーニング時において、CK が基準値上限の 2.5 倍以上の高値を示した患者
9) スクリーニング時において、推算糸球体濾過量(eGFR)が 45 mL/min/1.73m2 未満であった患
者
10)妊婦、授乳婦又は妊娠している可能性のある患者
11)患者本人又はパートナーが妊娠を希望している、又は同意取得時から被験薬の最終服用後 30
日までの期間、避妊を実施することに同意できない患者
12)同意取得前に医師主導治験(DA350103)以外の臨床試験に参加し、かつ同意取得時点で同臨
床試験の被験薬投与から 30 日間経過していない患者(同臨床試験の被験薬の半減期を 5 倍し
22
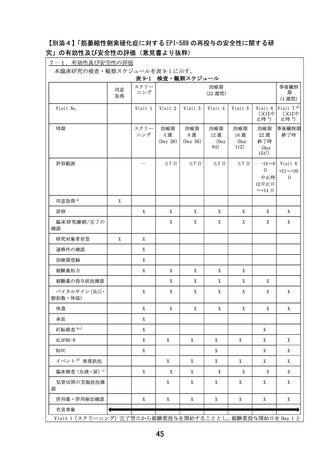
大阪大学医学部附属病院において、患者申出療養制度に基づき、スクリーニング時に、以下の選択
基準を全て満たし、かつ除外基準に抵触する項目がない症例を適格症例とする。
選択基準:下記の基準を全て満たした患者を対象とする。
1) 本臨床研究への参加について、本人より文書同意が得られた患者(同意能力はあるものの身
体が不自由なため、同意文書への自筆による署名ができない場合、代筆者による署名が得ら
れた患者)
2) 医師主導治験(DA350103)にエントリーされ、約 24 週間 EPI-589 の投与を受けたことがあ
り、安全性及び忍容性に問題がなかった患者
3) 外来通院が可能な患者
【選択基準の設定根拠】
1) 適切な同意が得られた研究対象者で研究を実施するために設定した。
2) 本臨床研究の目的は、EPI-589 を再投与したときの安全性及び忍容性を検討することである。
EPI-589 を再投与した実績がないため、医師主導治験で EPI-589 500 mg(EPI-589 250mg 錠 2
錠)を 1 日 3 回 24 週間投与した際の安全性及び忍容性に問題がなかった ALS 患者を対象に再
投与における安全性及び忍容性を検討することとした。
3) 本臨床研究では外来通院する必要があるため、設定した。
除外基準:下記の基準に一つでも当てはまる患者は対象としない。
1) 臨床的に意義のある重度の ALS 以外の合併症、既往症を有し、研究責任医師又は研究分担医
師が臨床研究の対象には不適切であると判断した患者
2) 精神疾患、認知機能障害、パーキンソン病を合併している患者
3) 気管切開を施行している患者
4) 非侵襲的呼吸補助装置の終日装着(22 時間以上の装着)をしている患者
5) 薬物アレルギー又は重度のアレルギー疾患(アナフィラキシーショック等)を既往又は合併
している患者
6) 悪性腫瘍を合併している、又は同意取得前 5 年以内に既往歴を有する患者
7) スクリーニング時において、AST、ALT が基準値上限の 3 倍以上の高値を示した患者
8) スクリーニング時において、CK が基準値上限の 2.5 倍以上の高値を示した患者
9) スクリーニング時において、推算糸球体濾過量(eGFR)が 45 mL/min/1.73m2 未満であった患
者
10)妊婦、授乳婦又は妊娠している可能性のある患者
11)患者本人又はパートナーが妊娠を希望している、又は同意取得時から被験薬の最終服用後 30
日までの期間、避妊を実施することに同意できない患者
12)同意取得前に医師主導治験(DA350103)以外の臨床試験に参加し、かつ同意取得時点で同臨
床試験の被験薬投与から 30 日間経過していない患者(同臨床試験の被験薬の半減期を 5 倍し
22