よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
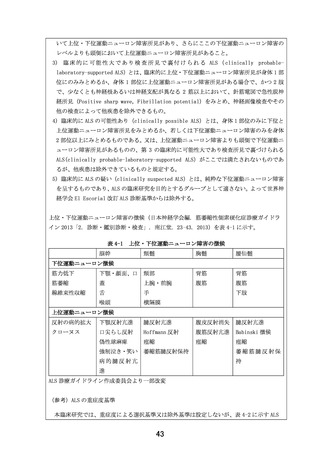
【別添6】
「筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研
究」の治療計画(意見書より抜粋)
6.治療計画
全例に EPI-589 を投与する(割付なし)
。
EPI-589 500 mg(EPI-589 250 mg 錠 2 錠)を 1 日 3 回食前(朝食、昼食、及び夕食のそれ
ぞれ 1 時間以上前)に経口投与する。投与期間は、治療期登録翌日から治療期 22 週時に規定
された、全ての検査・観察の終了時までとする。
個々の研究対象者の中止
臨床研究中止基準
以下の場合、研究責任医師等は当該研究対象者の臨床研究を中止する。
1)
研究対象者より臨床研究参加継続拒否又は同意撤回の申し出があった場合
2)
有害事象の発現を認め、研究責任医師又は研究分担医師が臨床研究の継続を困難と判
断した場合
3)
研究対象者の妊娠の報告があった場合
4)
投与開始前に、研究対象者が不適格な症例であると判明した場合
5)
投与開始後に、研究対象者が不適格な症例であると判明した場合
6)
研究責任医師又は研究分担医師が、有効性評価又は安全性確保の観点等で臨床研究の
中止を適切と判断した場合
7)
非侵襲的呼吸補助装置の終日装着
8)
侵襲的呼吸補助装置の装着又は死亡が発生した場合
臨床研究中止・中断手続き
研究責任医師等は、臨床研究を中止する旨を当該研究対象者に速やかに説明し、適切な医療の
提供及びその他必要な措置を講じる。中止日(医師が中止と判定した日)及びその理由を症例
報告書に記録する。また、中止日から 14 日以内に、臨床研究中止時における所定の項目を調
査し、評価する。
研究対象者の妊娠による臨床研究中止の場合は、胎児/出生児への影響を追跡調査し、調査結
果を被験薬提供者に報告する。
中止例においても、可能な限り事後観察期を実施する。
51
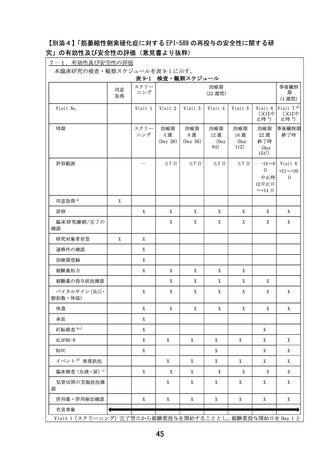
「筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研
究」の治療計画(意見書より抜粋)
6.治療計画
全例に EPI-589 を投与する(割付なし)
。
EPI-589 500 mg(EPI-589 250 mg 錠 2 錠)を 1 日 3 回食前(朝食、昼食、及び夕食のそれ
ぞれ 1 時間以上前)に経口投与する。投与期間は、治療期登録翌日から治療期 22 週時に規定
された、全ての検査・観察の終了時までとする。
個々の研究対象者の中止
臨床研究中止基準
以下の場合、研究責任医師等は当該研究対象者の臨床研究を中止する。
1)
研究対象者より臨床研究参加継続拒否又は同意撤回の申し出があった場合
2)
有害事象の発現を認め、研究責任医師又は研究分担医師が臨床研究の継続を困難と判
断した場合
3)
研究対象者の妊娠の報告があった場合
4)
投与開始前に、研究対象者が不適格な症例であると判明した場合
5)
投与開始後に、研究対象者が不適格な症例であると判明した場合
6)
研究責任医師又は研究分担医師が、有効性評価又は安全性確保の観点等で臨床研究の
中止を適切と判断した場合
7)
非侵襲的呼吸補助装置の終日装着
8)
侵襲的呼吸補助装置の装着又は死亡が発生した場合
臨床研究中止・中断手続き
研究責任医師等は、臨床研究を中止する旨を当該研究対象者に速やかに説明し、適切な医療の
提供及びその他必要な措置を講じる。中止日(医師が中止と判定した日)及びその理由を症例
報告書に記録する。また、中止日から 14 日以内に、臨床研究中止時における所定の項目を調
査し、評価する。
研究対象者の妊娠による臨床研究中止の場合は、胎児/出生児への影響を追跡調査し、調査結
果を被験薬提供者に報告する。
中止例においても、可能な限り事後観察期を実施する。
51