よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
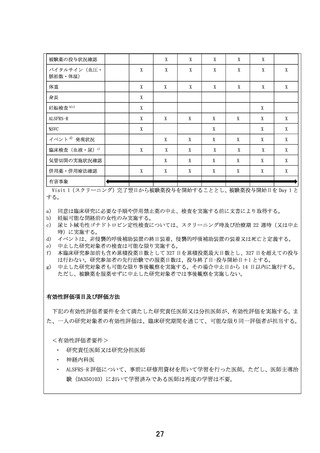
3.これまでに実施した医師主導治験(DA350103)では、EPI-589 を 24 週間投与されています。一方
で、今回の試験では 22 週間の投与となっています。事務局からの事前質問により、22 週間投与の
妥当性を、特に薬物動態学的特性の観点から述べられており、理解できます。
一方で、患者さんの説明文書(p6)には、以下のような記載があります(下線は質問者)。
「本研究では医師主導治験(DA350103)で用いたものと同じ EPI-589 の錠剤を用います。この錠剤
の製造過程で含まれる不純物による健康への影響が十分に低いと考えられる投与量から算出して
本研究での投与期間(22 週間)が設定されています。そのため今後さらに長期間の EPI-589 の投与
による安全性と有効性を確認する際には、本研究とは異なる剤形への変更が必要になります。」
事務局からの事前質問の回答と、患者説明文書の記載内容が異なり混乱します。特に患者説明
文書では、医師主導治験での 24 週間投与では、不純物の影響はなかったのか?と患者さんを不安
にさせるかもしれません。
改めて 22 週間投与の根拠について教えてください。
【回答】
本研究での 22 週間投与の根拠ですが、ICH M7 ガイドラインに従い、EPI-589 原薬の製造工程のリス
クアセスメントを実施しました。その結果、クラス 2 及びクラス 3 に該当する不純物は、原薬への混入リ
スクがないことを確認しました。クラス 1(Cohort of concern)に関しましては、溶媒として N-メチル-2-ピ
ロリドンを使用することから N-ニトロソ-N-メチル-4-アミノ酪酸(NMBA)についてリスクアセスメントを実
施し、原薬中の混入量が定量限界(5 ppm)未満(参考値:1.1 ppm)であることを確認しました。EPI-589
の 1 日最大投与量 1500mg から算出される NMBA の 1 日摂取量と、発がんリスク 1×10-5(NMBA の許
容摂取量:96.0 ng/day)の関係から算出される最大投与日数は 327 日間となります。本臨床研究に先
行し実施している医師主導治験(DA350103)において既に 24 週間(約 168 日間)投与された研究対象
者が組み入れられる予定であるため、治療期を 22 週間(約 154 日間)と設定しました。
今回対象となる被験者には上記の算出根拠は説明しております。
4.今回、医師主導治験で有効性が認められた患者さんの申し出によって、患者申出療養が計画され
ています。もし、その期間中に効果が認められれば、計画終了時に、再度患者さんを苦しませること
はないのかという懸念があります。患者説明書(p8)には、「研究終了後は、あなたに最も適切と考え
る医療を選択して提供します。」とあります。
22 週の投与期間が終わった際の患者対応や、そのことを患者さんにどの程度事前に説明するの
かについて、改めて見解を教えて下さい。
【回答】
本研究での投与期間が 22 週間であり、それを超えて投与を継続することができないことは、上記の質
問3に対する回答中の算出根拠によって被験者に説明しております。投与期間が終了した際の対応に
つきましては、本疾患に保険適応のあるリルゾール(本研究中は継続予定)に加えてエダラボン(本研究
中は併用禁忌)の内服を行っていただくとともに、終了時点で新たな薬剤が承認された場合にはその使
用を行っていく旨を説明しております。
13
で、今回の試験では 22 週間の投与となっています。事務局からの事前質問により、22 週間投与の
妥当性を、特に薬物動態学的特性の観点から述べられており、理解できます。
一方で、患者さんの説明文書(p6)には、以下のような記載があります(下線は質問者)。
「本研究では医師主導治験(DA350103)で用いたものと同じ EPI-589 の錠剤を用います。この錠剤
の製造過程で含まれる不純物による健康への影響が十分に低いと考えられる投与量から算出して
本研究での投与期間(22 週間)が設定されています。そのため今後さらに長期間の EPI-589 の投与
による安全性と有効性を確認する際には、本研究とは異なる剤形への変更が必要になります。」
事務局からの事前質問の回答と、患者説明文書の記載内容が異なり混乱します。特に患者説明
文書では、医師主導治験での 24 週間投与では、不純物の影響はなかったのか?と患者さんを不安
にさせるかもしれません。
改めて 22 週間投与の根拠について教えてください。
【回答】
本研究での 22 週間投与の根拠ですが、ICH M7 ガイドラインに従い、EPI-589 原薬の製造工程のリス
クアセスメントを実施しました。その結果、クラス 2 及びクラス 3 に該当する不純物は、原薬への混入リ
スクがないことを確認しました。クラス 1(Cohort of concern)に関しましては、溶媒として N-メチル-2-ピ
ロリドンを使用することから N-ニトロソ-N-メチル-4-アミノ酪酸(NMBA)についてリスクアセスメントを実
施し、原薬中の混入量が定量限界(5 ppm)未満(参考値:1.1 ppm)であることを確認しました。EPI-589
の 1 日最大投与量 1500mg から算出される NMBA の 1 日摂取量と、発がんリスク 1×10-5(NMBA の許
容摂取量:96.0 ng/day)の関係から算出される最大投与日数は 327 日間となります。本臨床研究に先
行し実施している医師主導治験(DA350103)において既に 24 週間(約 168 日間)投与された研究対象
者が組み入れられる予定であるため、治療期を 22 週間(約 154 日間)と設定しました。
今回対象となる被験者には上記の算出根拠は説明しております。
4.今回、医師主導治験で有効性が認められた患者さんの申し出によって、患者申出療養が計画され
ています。もし、その期間中に効果が認められれば、計画終了時に、再度患者さんを苦しませること
はないのかという懸念があります。患者説明書(p8)には、「研究終了後は、あなたに最も適切と考え
る医療を選択して提供します。」とあります。
22 週の投与期間が終わった際の患者対応や、そのことを患者さんにどの程度事前に説明するの
かについて、改めて見解を教えて下さい。
【回答】
本研究での投与期間が 22 週間であり、それを超えて投与を継続することができないことは、上記の質
問3に対する回答中の算出根拠によって被験者に説明しております。投与期間が終了した際の対応に
つきましては、本疾患に保険適応のあるリルゾール(本研究中は継続予定)に加えてエダラボン(本研究
中は併用禁忌)の内服を行っていただくとともに、終了時点で新たな薬剤が承認された場合にはその使
用を行っていく旨を説明しております。
13