よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
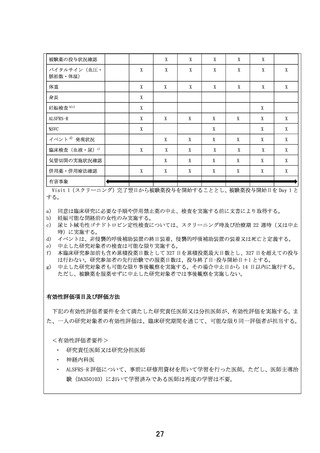
図 2 1 日 3 回反復投与時の 血漿中濃度 シミュレーション結果
有効性の観点からは、ALS 患者を対象とした海外第Ⅱ相試験(EPI589-15-001 試験)において、19
名を対象に本薬 500 mg を 1 日 2 回 90 日間投与したときの有効性を、単群非盲検試験により
評価しています。結果、治療期 3 ヵ月間 と投与後 3 ヵ月間(事後観察期)の ALSFRS-R スコア
の変化の傾きを比較したところ、EPI-589 投与期間中、進行速度が低下していたことが示唆され
ました。以上より、本薬 500 mg を 1 日 2 回投与することで一定の有効性は期待できると考え
ました。本薬の分布相の血漿中濃度の消失が速いという薬物動態特性を考慮して、1 日 3 回投与
することで、より高い血漿中濃度の維持が期待できると考え、有効性の観点からも上記の用法用
量を設定することが妥当と考えました。
投与期間
本試験は前治験(24 週投与)が問題なく終了した患者を対象とし、初回投与後 22 週間投与するデ
ザインとなっており、前後の投与間に少なくとも 6 ヶ月の休薬期間があります。この期間は、前
述の EPI-589 の国内臨床薬理試験(試験番号 DA301006)の結果より半減期が 8-10 時間と推定さ
れることおよび反復投与にても蓄積性がないことの 2 点に加えて、EPI-589 の国内臨床薬理試験
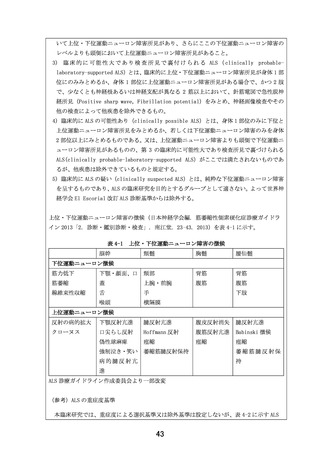
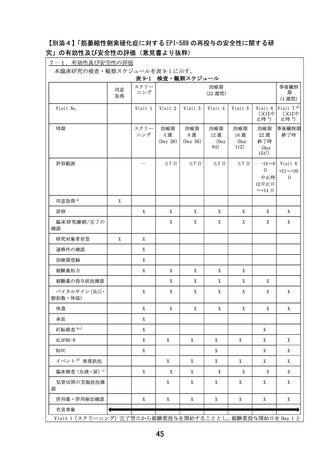
(試験番号 DA301006)の反復投与最終日(Day7)からの血漿中濃度の測定結果(図3および表2)
より本試験で使用される投与量(500mg)での血漿中濃度が、反復投与(Day7)後 12 時間(156 h)
で十分に低下しており、さらに反復投与(Day7)後 48 時間では検出限度以下まで低下しているこ
とから、wash-out 期間としては十分であると考えられます。従って総投与期間は 46 週と長期と
なりますが、本試験においては、22 週間(24 週未満)の投与であるため、前治験の 24 週投与で
の安全性・忍容性が参照可能と考えられ、本試験の投与期間である 22 週の間に前治験の投与期間
24 週で観察されなかった新たな安全性に問題のある重篤な有害事象が観察されるとは考えにくい
です。連続投与期間の長さという点では、「カニクイザルにおける 39 週間経口投与毒性試験及び
31 日間回復性試験(GLP 適用)
(試験番号:1660-080)(以下、サル 39 週間毒性試験)
」が最も長
9
有効性の観点からは、ALS 患者を対象とした海外第Ⅱ相試験(EPI589-15-001 試験)において、19
名を対象に本薬 500 mg を 1 日 2 回 90 日間投与したときの有効性を、単群非盲検試験により
評価しています。結果、治療期 3 ヵ月間 と投与後 3 ヵ月間(事後観察期)の ALSFRS-R スコア
の変化の傾きを比較したところ、EPI-589 投与期間中、進行速度が低下していたことが示唆され
ました。以上より、本薬 500 mg を 1 日 2 回投与することで一定の有効性は期待できると考え
ました。本薬の分布相の血漿中濃度の消失が速いという薬物動態特性を考慮して、1 日 3 回投与
することで、より高い血漿中濃度の維持が期待できると考え、有効性の観点からも上記の用法用
量を設定することが妥当と考えました。
投与期間
本試験は前治験(24 週投与)が問題なく終了した患者を対象とし、初回投与後 22 週間投与するデ
ザインとなっており、前後の投与間に少なくとも 6 ヶ月の休薬期間があります。この期間は、前
述の EPI-589 の国内臨床薬理試験(試験番号 DA301006)の結果より半減期が 8-10 時間と推定さ
れることおよび反復投与にても蓄積性がないことの 2 点に加えて、EPI-589 の国内臨床薬理試験
(試験番号 DA301006)の反復投与最終日(Day7)からの血漿中濃度の測定結果(図3および表2)
より本試験で使用される投与量(500mg)での血漿中濃度が、反復投与(Day7)後 12 時間(156 h)
で十分に低下しており、さらに反復投与(Day7)後 48 時間では検出限度以下まで低下しているこ
とから、wash-out 期間としては十分であると考えられます。従って総投与期間は 46 週と長期と
なりますが、本試験においては、22 週間(24 週未満)の投与であるため、前治験の 24 週投与で
の安全性・忍容性が参照可能と考えられ、本試験の投与期間である 22 週の間に前治験の投与期間
24 週で観察されなかった新たな安全性に問題のある重篤な有害事象が観察されるとは考えにくい
です。連続投与期間の長さという点では、「カニクイザルにおける 39 週間経口投与毒性試験及び
31 日間回復性試験(GLP 適用)
(試験番号:1660-080)(以下、サル 39 週間毒性試験)
」が最も長
9