よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別添5】
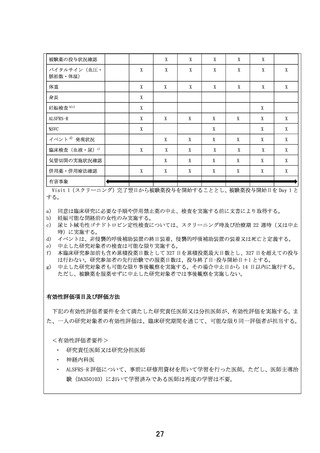
「筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研
究」の予定の試験期間及び症例数(意見書より抜粋)
7-2.予定の試験期間及び症例数
予定試験期間:jRCT 公表日~2024 年 12 月 31 日
予定症例数:3 例
既に実績のある症例数:無し
予定試験期間及び予定症例数の設定根拠:
医師主導治験(DA350103)での登録例数(10 例)のうち、再投与が見込まれる患者数を設定
した。
予定試験期間に関して、ICH M7 ガイドラインに従い、EPI-589 原薬の製造工程のリスクアセ
スメントを実施した。その結果、クラス 2 及びクラス 3 に該当する不純物は、原薬への混入
リスクがないことを確認した。クラス 1(Cohort of concern)に関しては、溶媒として Nメチル-2-ピロリドンを使用することから N-ニトロソ-N-メチル-4-アミノ酪酸(NMBA)につ
いてリスクアセスメントを実施し、原薬中の混入量が定量限界(5 ppm)未満(参考値:1.1
ppm)であることを確認した。EPI-589 の 1 日最大投与量 1500mg から算出される NMBA の 1 日
摂取量と、発がんリスク 1×10-5(NMBA の許容摂取量:96.0 ng/day)の関係から算出され
る最大投与日数は 327 日間となる。本臨床研究に先行し実施している医師主導治験
(DA350103)において既に 24 週間(約 168 日間)投与された研究対象者が組み入れられる
予定であるため、治療期を 22 週間(約 154 日間)と設定した。
50
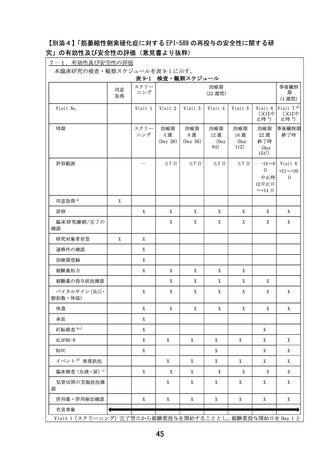
「筋萎縮性側索硬化症に対する EPI-589 の再投与の安全性に関する研
究」の予定の試験期間及び症例数(意見書より抜粋)
7-2.予定の試験期間及び症例数
予定試験期間:jRCT 公表日~2024 年 12 月 31 日
予定症例数:3 例
既に実績のある症例数:無し
予定試験期間及び予定症例数の設定根拠:
医師主導治験(DA350103)での登録例数(10 例)のうち、再投与が見込まれる患者数を設定
した。
予定試験期間に関して、ICH M7 ガイドラインに従い、EPI-589 原薬の製造工程のリスクアセ
スメントを実施した。その結果、クラス 2 及びクラス 3 に該当する不純物は、原薬への混入
リスクがないことを確認した。クラス 1(Cohort of concern)に関しては、溶媒として Nメチル-2-ピロリドンを使用することから N-ニトロソ-N-メチル-4-アミノ酪酸(NMBA)につ
いてリスクアセスメントを実施し、原薬中の混入量が定量限界(5 ppm)未満(参考値:1.1
ppm)であることを確認した。EPI-589 の 1 日最大投与量 1500mg から算出される NMBA の 1 日
摂取量と、発がんリスク 1×10-5(NMBA の許容摂取量:96.0 ng/day)の関係から算出され
る最大投与日数は 327 日間となる。本臨床研究に先行し実施している医師主導治験
(DA350103)において既に 24 週間(約 168 日間)投与された研究対象者が組み入れられる
予定であるため、治療期を 22 週間(約 154 日間)と設定した。
50