よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
する。
a)
b)
c)
d)
e)
f)
g)
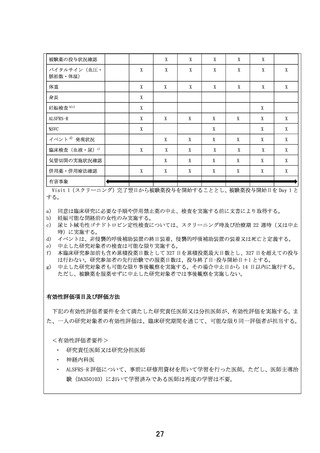
同意は臨床研究に必要な手順や併用禁止薬の中止、検査を実施する前に文書により取得する。
妊娠可能な閉経前の女性のみ実施する。
尿ヒト絨毛性ゴナドトロピン定性検査については、スクリーニング時及び治療期 22 週時(又は中止
時)に実施する。
イベントは、非侵襲的呼吸補助装置の終日装着、侵襲的呼吸補助装置の装着又は死亡と定義する。
中止した研究対象者の検査は可能な限り実施する。
本臨床研究参加前も含め累積投薬日数として 327 日を累積投薬最大日数とし、327 日を超えての投与
は行わない。研究参加者の先行治験での服薬日数は、投与終了日−投与開始日+1 とする。
中止した研究対象者も可能な限り事後観察を実施する。その場合中止日から 14 日以内に施行する。
ただし、被験薬を服薬せずに中止した研究対象者では事後観察を実施しない。
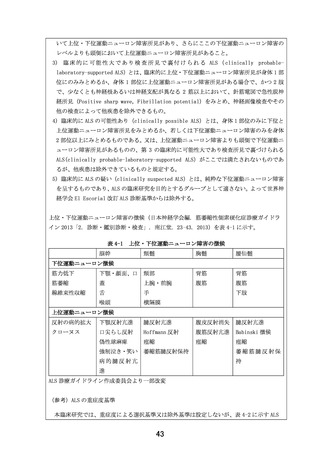
有効性評価項目及び評価方法
下記の有効性評価者要件を全て満たした研究責任医師又は分担医師が、有効性評価を実施する。ま
た、一人の研究対象者の有効性評価は、臨床研究期間を通じて、可能な限り同一評価者が担当する。
<有効性評価者要件>
・ 研究責任医師又は研究分担医師
・ 神経内科医
・ ALSFRS-R 評価について、事前に研修用資材を用いて学習を行った医師。ただし、医師主導治
験(DA350103)において学習済みである医師は再度の学習は不要。
ALSFRS-R
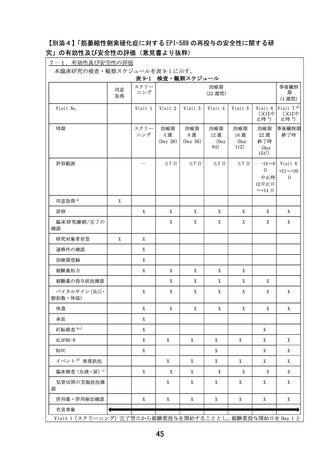
研究責任医師又は研究分担医師は、表 9-1 に従って、日常生活動作及び呼吸機能の状態等を調査
し、「ALSFRS-R 評価の手引き」に従って、ALSFRS-R(Kollewe K et al. ALSFRS-R score and its
ratio: A useful predictor for ALS-progression. J Neurol. 275: 69–73. 2008)を評価する。ま
た、評価実施日、評価者、回答者及び各 Item の点数を症例報告書に記録する。
%SVC
%SVC を測定し、測定日及び測定結果を症例報告書に記録する。なお、可能な限り同一評価者が計測
することとする。
イベント
研究責任医師又は研究分担医師は、表 9-1 に従って、原疾患の進行による「非侵襲的呼吸補助装置
の終日装着」、「侵襲的呼吸補助装置の装着」又は「死亡」をイベントと定義し、その発現状況を調
査する。ただし、「死亡」については、原因に関わらず全てをイベントとする。イベントが発現した
場合は、イベント名及びイベント発生日を症例報告書に記録する。イベント発生日は、非侵襲的呼吸
補助装置の終日装着(22 時間以上の装着)が開始された日、侵襲的呼吸補助装置の装着が開始された
日、又は死亡日とする。
46
a)
b)
c)
d)
e)
f)
g)
同意は臨床研究に必要な手順や併用禁止薬の中止、検査を実施する前に文書により取得する。
妊娠可能な閉経前の女性のみ実施する。
尿ヒト絨毛性ゴナドトロピン定性検査については、スクリーニング時及び治療期 22 週時(又は中止
時)に実施する。
イベントは、非侵襲的呼吸補助装置の終日装着、侵襲的呼吸補助装置の装着又は死亡と定義する。
中止した研究対象者の検査は可能な限り実施する。
本臨床研究参加前も含め累積投薬日数として 327 日を累積投薬最大日数とし、327 日を超えての投与
は行わない。研究参加者の先行治験での服薬日数は、投与終了日−投与開始日+1 とする。
中止した研究対象者も可能な限り事後観察を実施する。その場合中止日から 14 日以内に施行する。
ただし、被験薬を服薬せずに中止した研究対象者では事後観察を実施しない。
有効性評価項目及び評価方法
下記の有効性評価者要件を全て満たした研究責任医師又は分担医師が、有効性評価を実施する。ま
た、一人の研究対象者の有効性評価は、臨床研究期間を通じて、可能な限り同一評価者が担当する。
<有効性評価者要件>
・ 研究責任医師又は研究分担医師
・ 神経内科医
・ ALSFRS-R 評価について、事前に研修用資材を用いて学習を行った医師。ただし、医師主導治
験(DA350103)において学習済みである医師は再度の学習は不要。
ALSFRS-R
研究責任医師又は研究分担医師は、表 9-1 に従って、日常生活動作及び呼吸機能の状態等を調査
し、「ALSFRS-R 評価の手引き」に従って、ALSFRS-R(Kollewe K et al. ALSFRS-R score and its
ratio: A useful predictor for ALS-progression. J Neurol. 275: 69–73. 2008)を評価する。ま
た、評価実施日、評価者、回答者及び各 Item の点数を症例報告書に記録する。
%SVC
%SVC を測定し、測定日及び測定結果を症例報告書に記録する。なお、可能な限り同一評価者が計測
することとする。
イベント
研究責任医師又は研究分担医師は、表 9-1 に従って、原疾患の進行による「非侵襲的呼吸補助装置
の終日装着」、「侵襲的呼吸補助装置の装着」又は「死亡」をイベントと定義し、その発現状況を調
査する。ただし、「死亡」については、原因に関わらず全てをイベントとする。イベントが発現した
場合は、イベント名及びイベント発生日を症例報告書に記録する。イベント発生日は、非侵襲的呼吸
補助装置の終日装着(22 時間以上の装着)が開始された日、侵襲的呼吸補助装置の装着が開始された
日、又は死亡日とする。
46