よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.EPI-589 を再投与することの安全性・有効性について説明してください。
【回答】
安全性について
本試験における EPI-589 を長期に投与することの安全性に関して、投与量、投与期間、剤型、起
こりうる有害事象、実施体制の観点から説明いたします。
投与量
本 試 験 で 使 用 さ れ る 投 与 量 は 「 EPI-589 の 筋 萎 縮 性 側 索 硬 化 症 を 対 象 と し た 探 索 的 試 験
(jRCT2061210031)(以下、前治験)」にて安全性・忍容性が良好であることが確認された用法用
量(EPI-589 500 mg を 1 日 3 回 食前に経口投与する)と同量です。また、用法用量の設定根
拠は、下記の通りです。
安全性の観点からは、国内臨床薬理試験(DA301006 試験)で健康成人に本薬を単回経口投与した
とき、1000 mg まで安全性及び忍容性に問題は認められませんでした。また、白人及び日本人の
健康成人男性に 1500 mg/日(本薬 750 mg 1 日 2 回)を反復投与したときにも、安全性及び忍
容性に問題は認められませんでした。更に患者対象の試験では、前治験にて国内 ALS 患者を対象
として 500 mg 1 日 3 回(1500 mg/日)24 週間投与したときの安全性及び忍容性が良好でした。
以上より、本薬 500 mg を 1 日 3 回経口投与する用法・用量は、設定可能と考えました。
薬物動態の観点については国内臨床薬理試験(DA301006 試験)で 1 日 2 回 5 日間 (Day2 から 6)
の反復投与前後に 1 日 1 回投与を行い、反復投与による薬物動態の変動を確認しています。反復
投与前(Day1)と反復投与後(Day7)の薬物動態パラメータ(Cmax および、投与 24 時間後までの時
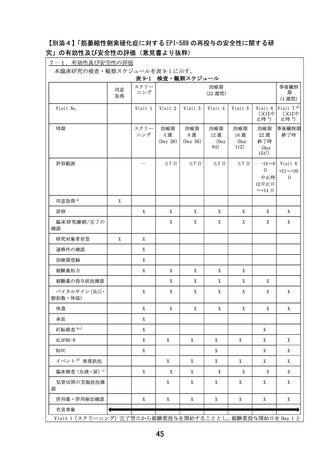
間-濃度曲線下面積 AUC0-24)の抜粋を以下に示します(表 1)
。Cmax は 500 mg 投与群で Day7 の方が
Day1よりも高くなっているように見えますが(Day7/Day1: 1.29)、750 mg 投与群の Cmax は Day1
と Day7 ではほぼ同じ値です(Day7/Day1: 1.02)
。また 1 日の総薬剤曝露量を示す AUC0-24 は両投与
量ともに反復投与前後でほぼ同じ値(500 mg の Day7/Day1: 1.07、750 mg の Day7/Day1: 0.98)
であることから、500 mg 投与群の Cmax で Day7 の方が Day1 よりも高くなっているように見えるの
は、データのばらつきによるものと考えられます。以上の結果から本薬を 1 日 2 回 5 日間反復投
与した際の曝露量(Cmax 及び AUC0-24)は反復投与前後でほぼ変わらず、反復投与時に本薬の体内へ
の蓄積は認められない、と判断されました。
7
【回答】
安全性について
本試験における EPI-589 を長期に投与することの安全性に関して、投与量、投与期間、剤型、起
こりうる有害事象、実施体制の観点から説明いたします。
投与量
本 試 験 で 使 用 さ れ る 投 与 量 は 「 EPI-589 の 筋 萎 縮 性 側 索 硬 化 症 を 対 象 と し た 探 索 的 試 験
(jRCT2061210031)(以下、前治験)」にて安全性・忍容性が良好であることが確認された用法用
量(EPI-589 500 mg を 1 日 3 回 食前に経口投与する)と同量です。また、用法用量の設定根
拠は、下記の通りです。
安全性の観点からは、国内臨床薬理試験(DA301006 試験)で健康成人に本薬を単回経口投与した
とき、1000 mg まで安全性及び忍容性に問題は認められませんでした。また、白人及び日本人の
健康成人男性に 1500 mg/日(本薬 750 mg 1 日 2 回)を反復投与したときにも、安全性及び忍
容性に問題は認められませんでした。更に患者対象の試験では、前治験にて国内 ALS 患者を対象
として 500 mg 1 日 3 回(1500 mg/日)24 週間投与したときの安全性及び忍容性が良好でした。
以上より、本薬 500 mg を 1 日 3 回経口投与する用法・用量は、設定可能と考えました。
薬物動態の観点については国内臨床薬理試験(DA301006 試験)で 1 日 2 回 5 日間 (Day2 から 6)
の反復投与前後に 1 日 1 回投与を行い、反復投与による薬物動態の変動を確認しています。反復
投与前(Day1)と反復投与後(Day7)の薬物動態パラメータ(Cmax および、投与 24 時間後までの時
間-濃度曲線下面積 AUC0-24)の抜粋を以下に示します(表 1)
。Cmax は 500 mg 投与群で Day7 の方が
Day1よりも高くなっているように見えますが(Day7/Day1: 1.29)、750 mg 投与群の Cmax は Day1
と Day7 ではほぼ同じ値です(Day7/Day1: 1.02)
。また 1 日の総薬剤曝露量を示す AUC0-24 は両投与
量ともに反復投与前後でほぼ同じ値(500 mg の Day7/Day1: 1.07、750 mg の Day7/Day1: 0.98)
であることから、500 mg 投与群の Cmax で Day7 の方が Day1 よりも高くなっているように見えるの
は、データのばらつきによるものと考えられます。以上の結果から本薬を 1 日 2 回 5 日間反復投
与した際の曝露量(Cmax 及び AUC0-24)は反復投与前後でほぼ変わらず、反復投与時に本薬の体内へ
の蓄積は認められない、と判断されました。
7