よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
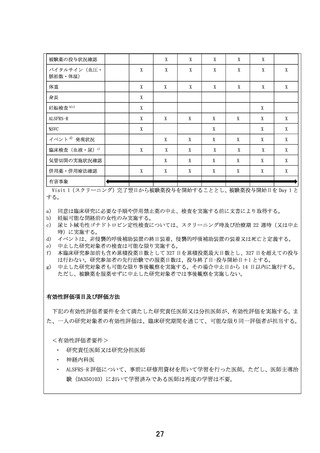
また、同様のガイダンスにおいて、ALS 治療薬の開発、評価において、呼吸機能や生存期間等の評
価も重要とされており、本試験では%SVC、イベントの評価項目を設定し、これらを客観的に評価いたし
ます。
以上のとおり、前治験と同様に本治験での有効性評価項目(ALSFRS-R、%SVC、イベント)で独立な
第 3 者による評価は行いませんが、ALS 治療薬の開発、評価において国際的にも推奨されている
ALSFRS-R、%SVC 及びイベントでの客観的な評価結果を総合的に考察するとともに、前治験の結果も
参照し、本試験結果の妥当性について担保することを考えております。
7.研究計画書18.2.1 モニタリングに際して、試験責任医師が指定したモニターが行うとあります
が、内部の場合モニタリング担当者の選考基準(どのような資格を持っているか等)を記載してくださ
い。
監査担当者についても試験責任医師が指名するとありますが、監査担当者は CRO などの外部
か、内部か記載してください。内部の場合監査担当者の選考基準(どのような資格を持っているか
等)を記載してください。
【回答】
本研究のモニタリングは内部(大阪大学医学部附属病院未来医療開発部臨床研究センター)で行わ
れます。
モニタリング担当者の選考基準は、以下の要件を満たす者になります。
1)研究に関する倫理的原則を理解していること
2)モニタリングに必要な科学的、臨床的知識を有していること
3)「臨床研究法」(平成 29 年法律第 16 号)、臨床研究法施行規則(平成 30 年厚生労働省令第 17
号)及び本臨床研究の実施に関連する各種法規制に関する教育・研修等を継続的に受けていること
4)本臨床研究の研究計画書、各種手順書等の内容を十分に理解していること
5)臨床研究の対象者の個人情報の保護及び本臨床研究に関連する機密の保全について理解してい
ること
また監査担当者につきましては、内部(大阪大学医学部附属病院 未来医療開発部 監査室)で行わ
れます。
監査担当責任者および監査担当者の要件は、大阪大学医学部附属病院未来医療開発部監査室の
「監査に関する標準業務手順書」に以下のように規定されています。
監査担当責任者
1)FDA Inspection 及び EMA Inspection の対応経験を有する。若しくはいずれか一方の対応経験を有
する。
2)PMDA Inspection(海外を含む)の対応経験を有する。若しくは PMDA Inspection(国内)の対応経験
を有する。
3)海外での医療機関監査の経験を有する。
4)国内での医療機関監査の経験を 100 件以上有する。
5)上記 1)~4)の条件と同等の経験を有すると監査室室長が判断する者。
監査担当者
15
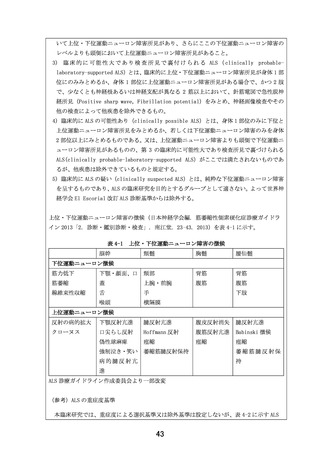
価も重要とされており、本試験では%SVC、イベントの評価項目を設定し、これらを客観的に評価いたし
ます。
以上のとおり、前治験と同様に本治験での有効性評価項目(ALSFRS-R、%SVC、イベント)で独立な
第 3 者による評価は行いませんが、ALS 治療薬の開発、評価において国際的にも推奨されている
ALSFRS-R、%SVC 及びイベントでの客観的な評価結果を総合的に考察するとともに、前治験の結果も
参照し、本試験結果の妥当性について担保することを考えております。
7.研究計画書18.2.1 モニタリングに際して、試験責任医師が指定したモニターが行うとあります
が、内部の場合モニタリング担当者の選考基準(どのような資格を持っているか等)を記載してくださ
い。
監査担当者についても試験責任医師が指名するとありますが、監査担当者は CRO などの外部
か、内部か記載してください。内部の場合監査担当者の選考基準(どのような資格を持っているか
等)を記載してください。
【回答】
本研究のモニタリングは内部(大阪大学医学部附属病院未来医療開発部臨床研究センター)で行わ
れます。
モニタリング担当者の選考基準は、以下の要件を満たす者になります。
1)研究に関する倫理的原則を理解していること
2)モニタリングに必要な科学的、臨床的知識を有していること
3)「臨床研究法」(平成 29 年法律第 16 号)、臨床研究法施行規則(平成 30 年厚生労働省令第 17
号)及び本臨床研究の実施に関連する各種法規制に関する教育・研修等を継続的に受けていること
4)本臨床研究の研究計画書、各種手順書等の内容を十分に理解していること
5)臨床研究の対象者の個人情報の保護及び本臨床研究に関連する機密の保全について理解してい
ること
また監査担当者につきましては、内部(大阪大学医学部附属病院 未来医療開発部 監査室)で行わ
れます。
監査担当責任者および監査担当者の要件は、大阪大学医学部附属病院未来医療開発部監査室の
「監査に関する標準業務手順書」に以下のように規定されています。
監査担当責任者
1)FDA Inspection 及び EMA Inspection の対応経験を有する。若しくはいずれか一方の対応経験を有
する。
2)PMDA Inspection(海外を含む)の対応経験を有する。若しくは PMDA Inspection(国内)の対応経験
を有する。
3)海外での医療機関監査の経験を有する。
4)国内での医療機関監査の経験を 100 件以上有する。
5)上記 1)~4)の条件と同等の経験を有すると監査室室長が判断する者。
監査担当者
15