よむ、つかう、まなぶ。
別紙1○患者申出療養に係る新規技術の科学的評価等について (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00025.html |
| 出典情報 | 患者申出療養評価会議(第41回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
画(CK-MM、CK-MB、CK-BB)
、LDH、尿酸、BUN、クレアチニン(eGFR 推算含む)
、Na、K、Cl、Ca、
P、グルコース、総コレステロール、トリグリセリド、LDL コレステロール、HDL コレステロー
ル
・尿検査(定性)
:尿糖、尿蛋白、尿潜血、ウロビリノーゲン、尿 pH、尿ビリルビン、ヒト絨
毛性ゴナドトロピン
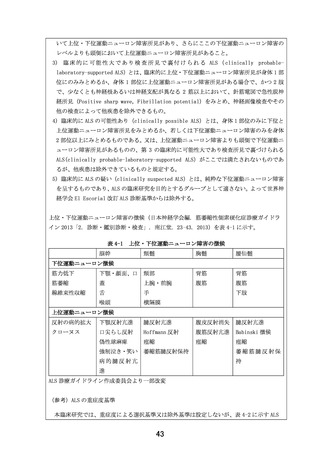
表 10-1 採血量及び採血回数
採血回数(回)
1 回当たりの採血量
項目
(mL/回)
スクリーニング
治療期
検査
臨床検査 a)
15.0
1
5
事後観察
合
期
計
1
7
採血量合計(mL)
105.0
a) 血液学的検査及び血液生化学的検査を含む。
バイタルサイン
研究責任医師、研究分担医師又は研究協力者は、表 9-1 に従って、血圧(収縮期・拡張期)、脈拍
数及び体温を測定し、測定日及び検査結果を症例報告書に記録する。
体重
研究責任医師、研究分担医師又は研究協力者は、表 9-1 に従って、体重を測定し、測定日及び検査
結果を症例報告書に記録する。
有害事象
同意取得後に発現した研究対象者の安全性に関わる症状及び徴候を診察(問診、視診、聴打診等)
により調査し、好ましくない又は意図しない症状・徴候を認めた場合は、症例報告書に記録する。
追跡調査は、原則として、症状・徴候の予後が明らかになるまで行うこととする。追跡調査の終了
時期は研究責任医師又は研究分担医師の医学的判断による。
なお、本臨床研究においては、原疾患の進行に伴う症状の悪化(気管切開、非侵襲的呼吸補助装置
の装着、侵襲的呼吸補助装置の装着、呼吸機能低下に関する自覚症状の出現・悪化等及び胃瘻造設等
であり、死亡を除く)と判断した事象は、有害事象として取り扱わないこととする。
研究対象者又は家族に対して、研究対象者が同意取得時から事後観察完了時、又は中止時までに他
科・他院を受診する場合は、原則として事前に連絡することを指導する。研究責任医師等は、研究対
象者の他科・他院の受診の有無を確認する。研究対象者が他科・他院を受診した場合には、治療内容
29
、LDH、尿酸、BUN、クレアチニン(eGFR 推算含む)
、Na、K、Cl、Ca、
P、グルコース、総コレステロール、トリグリセリド、LDL コレステロール、HDL コレステロー
ル
・尿検査(定性)
:尿糖、尿蛋白、尿潜血、ウロビリノーゲン、尿 pH、尿ビリルビン、ヒト絨
毛性ゴナドトロピン
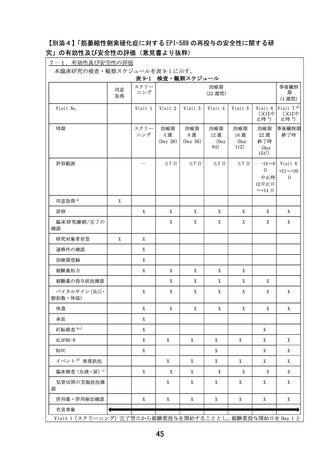
表 10-1 採血量及び採血回数
採血回数(回)
1 回当たりの採血量
項目
(mL/回)
スクリーニング
治療期
検査
臨床検査 a)
15.0
1
5
事後観察
合
期
計
1
7
採血量合計(mL)
105.0
a) 血液学的検査及び血液生化学的検査を含む。
バイタルサイン
研究責任医師、研究分担医師又は研究協力者は、表 9-1 に従って、血圧(収縮期・拡張期)、脈拍
数及び体温を測定し、測定日及び検査結果を症例報告書に記録する。
体重
研究責任医師、研究分担医師又は研究協力者は、表 9-1 に従って、体重を測定し、測定日及び検査
結果を症例報告書に記録する。
有害事象
同意取得後に発現した研究対象者の安全性に関わる症状及び徴候を診察(問診、視診、聴打診等)
により調査し、好ましくない又は意図しない症状・徴候を認めた場合は、症例報告書に記録する。
追跡調査は、原則として、症状・徴候の予後が明らかになるまで行うこととする。追跡調査の終了
時期は研究責任医師又は研究分担医師の医学的判断による。
なお、本臨床研究においては、原疾患の進行に伴う症状の悪化(気管切開、非侵襲的呼吸補助装置
の装着、侵襲的呼吸補助装置の装着、呼吸機能低下に関する自覚症状の出現・悪化等及び胃瘻造設等
であり、死亡を除く)と判断した事象は、有害事象として取り扱わないこととする。
研究対象者又は家族に対して、研究対象者が同意取得時から事後観察完了時、又は中止時までに他
科・他院を受診する場合は、原則として事前に連絡することを指導する。研究責任医師等は、研究対
象者の他科・他院の受診の有無を確認する。研究対象者が他科・他院を受診した場合には、治療内容
29